��Ŀ����
����Ŀ��(1)��ʵ֤��������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ�����л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���__________��
A��C(s)+H2O(g)=CO(g)+H2(g) ��H>0
B��2H2(g)+O2(g)=2H2O(1) ��H<0
C��NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) ��H<0
(2) ��KOH��ҺΪ�������Һ�������⣨1����ѡ��Ӧ���һ��ԭ��أ��为���ĵ缫��ӦʽΪ_______��

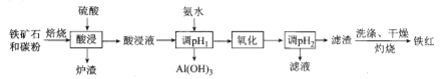
(3) ���ԭ���ڻ�ѧ��ҵ�����Ź㷺��Ӧ�á��ֽ�����Ƶ�ԭ���ͨ����������ͼ�е�������������aΪ���Һ��X��Y��Ϊ���Ե缫����
����aΪCuSO4��Һ������ʱ�Ļ�ѧ��Ӧ����ʽΪ___________________��
������⺬��0.04molCuSO4��0.04molNaCl�Ļ����Һ400ml������������������672 mL����״���£�ʱ����Һ��c��H+�� = _____�����������Һ������䣩��
���𰸡�B H2 - 2eһ + 2 OHһ= 2 H2O 2CuSO4+2H2O![]() 2Cu+O2+2H2SO4 0.1mol/L
2Cu+O2+2H2SO4 0.1mol/L
��������
��1������ԭ���ԭ���������Ϣ֪������Ƴ�ԭ��صķ�Ӧ�����Ƿ��ȵ�������ԭ��Ӧ��
��2����KOH��ҺΪ�������Һ������ȼ�ϵ���У������������õ��Ӻ����������ӷ�Ӧ����ˮ��
��3���ؼ�����ȷ���ԭ�����ر�����Һ�����ӵķŵ�˳����
��1������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ���ұ��������Է����е�������ԭ��Ӧ��
A.�÷�Ӧ�����ȷ�Ӧ�����Բ�����Ƴ�ԭ��أ���A����
B.�÷�Ӧ�Ƿ��ȷ�Ӧ�����Է��Ľ���������ԭ��Ӧ����������Ƴ�ԭ��أ���B��ȷ��
C.�÷�Ӧ����������ԭ��Ӧ�����Բ�����Ƴ�ԭ��أ���C����
��ѡB��
��2������Ӧ2H2(g)+O2(g)=2H2O(1) ��H<0����Ƴ�ԭ��أ��õ��Ϊȼ�ϵ�ء�����ԭ���ԭ��������������������Ӧ��������������ԭ��Ӧ��ȼ��H2�ڸ�������Ӧ����ȼ��O2���������μӷ�Ӧ�������KOH��ҺΪ�������Һ���为���缫��ӦʽΪ��H2 - 2e- + 2 OH-= 2 H2O���ʴ�Ϊ��H2 - 2e- + 2 OH-= 2 H2O��
��3���ٵ������ͭ��Һʱ����������������������������ͭ��ͬʱ��Һ���������ᣬ���Ե�ط�ӦʽΪ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4���ʴ�Ϊ��2CuSO4+2H2O
2Cu+O2��+2H2SO4���ʴ�Ϊ��2CuSO4+2H2O![]() 2Cu+O2��+2H2SO4��
2Cu+O2��+2H2SO4��
����⺬��0.04mol CuSO4��0.04mol NaCl�Ļ����Һ400mL�����������������ӷŵ磬�����������������Һ�е�OH���ŵ磬�������������������ӵ����ʵ�����0.04mol��������ȫ�ŵ磬�����������0.02mol����״���µ������448mL��������ʵ��������������Ϊ672mL�������бض��������������ʵ�����0.01mol����Ӧ�й�ת�Ƶ��ӵ����ʵ�����0.08mol������������ͭ���ӷŵ磬�������Һ�е������ӷŵ硣0.04molͭ����ǡ�õõ�0.08mol���ӣ�����0.04mol����ͭ�����Ե�����Һ�е�������0.02mol�����ƺ�0.02mol���ᣬ����Һ�������ӵ�Ũ����0.04mol��0.4L��0.1mol/L���ʴ�Ϊ��0.1mol/L��

 ����νӽ̲���ĩ���Ԥϰ�人������ϵ�д�
����νӽ̲���ĩ���Ԥϰ�人������ϵ�д� ������ҵ��ٳɳ����½������������ϵ�д�
������ҵ��ٳɳ����½������������ϵ�д�