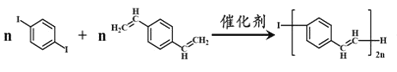
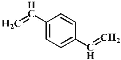
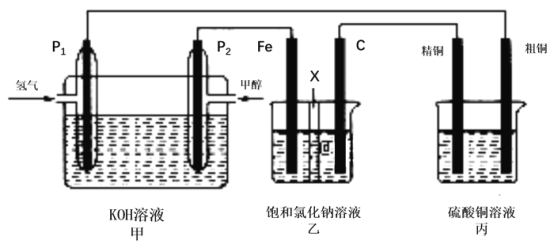
题目内容
【题目】在一定温度下,可逆反应X(g)+3Y(g)![]() 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
①Z生成的速率与Z分解的速率相等 ②单位时间生成a mol X,同时生成3a mol Y
③X、Y、Z的浓度不再变化 ④X、Y、Z的分子数比为1:3:2
⑤X、Y、Z的浓度相等 ⑥X、Y、Z的质量不再发生变化
A.①③⑥B.①②③C.①②⑤⑥D.①②③④⑤⑥
【答案】A
【解析】
①Z生成的速率与Z分解的速率相等,说明物质Z的浓度不再变化,反应达到了平衡;
②单位时间生成a mol X,同时生成3a mol Y,只能说明了逆反应速率,没有说明逆反应速率和正反应速率的关系,不能说明反应达到平衡;
③浓度不变,说明反应达到平衡;
④分子数比为1:3:2,但不能说明物质的分子数保持不变;
⑤三种物质的浓度相等,不能说明反应达到平衡;
⑥各物质的质量不再发生变化,说明反应达到平衡;
故选A。

【题目】研究CO、CO2的回收对减少碳的排放、改善生态环境和构建生态文明具有重要的意义。回答下列问题:
(1)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH=99 kJ·mol1
CH3OH(g) ΔH=99 kJ·mol1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ·mol1
CO(g)+H2O(g) ΔH=+41 kJ·mol1
则反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=_________。
CH3OH(g)+H2O(g) ΔH=_________。
(2)向容积相同的三个恒容密闭容器中分别通入一定量H2、CO,控制适当条件使其发生反应:2H2(g)+CO(g)![]() CH3OH(g),反应中有关数据如下表所示:
CH3OH(g),反应中有关数据如下表所示:
容器 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | |
c(H2) | c(CO) | c(CH3OH) | ||
A | 350 | 0.40 | 0.20 | 0.16 |
B | 350 | 0.80 | 0.40 | |
C | T | 0.40 | 0.20 | 0.05 |
反应从开始到达到平衡时,平均反应速率:容器A____容器C(填“>”或“<”,后同),容器B中CO的转化率____80%。
(3)①CO2和H2在一定条件下能发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
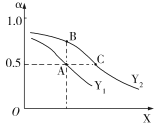
X表示___(填“温度”或“压强”),状态A、B、C对应的平衡常数K(A)、K(B)、K(C)的相对大小顺序为_____。
②向M、N两个初始容积相同的密闭容器中各充入2 mol CO2 和6 mol H2,控制适当条件使其发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
(4)用NaOH溶液做碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=10的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(
)=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。