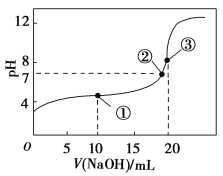
ЬтФПФкШн
ЁОЬтФПЁПбаОПCOЁЂCO2ЕФЛиЪеЖдМѕЩйЬМЕФХХЗХЁЂИФЩЦЩњЬЌЛЗОГКЭЙЙНЈЩњЬЌЮФУїОпгаживЊЕФвтвхЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉвбжЊЃКЂйCO(g)+2H2(g)![]() CH3OH(g) ІЄH=99 kJЁЄmol1
CH3OH(g) ІЄH=99 kJЁЄmol1
ЂкCO2(g)+H2(g)![]() CO(g)+H2O(g) ІЄH=+41 kJЁЄmol1
CO(g)+H2O(g) ІЄH=+41 kJЁЄmol1
дђЗДгІCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ІЄH=_________ЁЃ
CH3OH(g)+H2O(g) ІЄH=_________ЁЃ
ЃЈ2ЃЉЯђШнЛ§ЯрЭЌЕФШ§ИіКуШнУмБеШнЦїжаЗжБ№ЭЈШывЛЖЈСПH2ЁЂCOЃЌПижЦЪЪЕБЬѕМўЪЙЦфЗЂЩњЗДгІЃК2H2(g)+CO(g)![]() CH3OH(g)ЃЌЗДгІжагаЙиЪ§ОнШчЯТБэЫљЪОЃК
CH3OH(g)ЃЌЗДгІжагаЙиЪ§ОнШчЯТБэЫљЪОЃК
ШнЦї | ЮТЖШ/K | ЮяжЪЕФЦ№ЪМХЈЖШ/mol/L | ЮяжЪЕФЦНКтХЈЖШ/mol/L | |
c(H2) | c(CO) | c(CH3OH) | ||
A | 350 | 0.40 | 0.20 | 0.16 |
B | 350 | 0.80 | 0.40 | |
C | T | 0.40 | 0.20 | 0.05 |
ЗДгІДгПЊЪМЕНДяЕНЦНКтЪБЃЌЦНОљЗДгІЫйТЪЃКШнЦїA____ШнЦїCЃЈЬюЁАЃОЁБЛђЁАЃМЁБЃЌКѓЭЌЃЉЃЌШнЦїBжаCOЕФзЊЛЏТЪ____80%ЁЃ
ЃЈ3ЃЉЂйCO2КЭH2дквЛЖЈЬѕМўЯТФмЗЂЩњШчЯТЗДгІЃК2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)ЁЁІЄH<0ЁЃЯђвЛКубЙУмБеШнЦїжаШы1 mol CO2 КЭ3 mol H2ЃЌШнЦїжаH2ЕФЦНКтзЊЛЏТЪІСЫцЮТЖШЁЂбЙЧПЕФБфЛЏШчЭМЫљЪОЁЃ
C2H4(g)+4H2O(g)ЁЁІЄH<0ЁЃЯђвЛКубЙУмБеШнЦїжаШы1 mol CO2 КЭ3 mol H2ЃЌШнЦїжаH2ЕФЦНКтзЊЛЏТЪІСЫцЮТЖШЁЂбЙЧПЕФБфЛЏШчЭМЫљЪОЁЃ
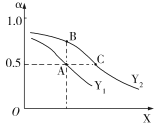
XБэЪО___ЃЈЬюЁАЮТЖШЁБЛђЁАбЙЧПЁБЃЉЃЌзДЬЌAЁЂBЁЂCЖдгІЕФЦНКтГЃЪ§K(A)ЁЂK(B)ЁЂK(C)ЕФЯрЖдДѓаЁЫГађЮЊ_____ЁЃ
ЂкЯђMЁЂNСНИіГѕЪМШнЛ§ЯрЭЌЕФУмБеШнЦїжаИїГфШы2 mol CO2 КЭ6 mol H2ЃЌПижЦЪЪЕБЬѕМўЪЙЦфЗЂЩњШчЯТЗДгІЃК2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)ІЄH<0ЁЃЦфжаMЮЊКубЙШнЦїЃЌNЮЊКуШнШнЦїЃЌШєЮЌГжСНШнЦїЕФЮТЖШЯрЭЌЃЌдђЦНКтЪБЛьКЯЦјЬхЦНОљЯрЖдЗжзгжЪСПНЯДѓЕФЪЧ______ЃЈЬюЁАMЁБЛђЁАNЁБЃЉЁЃ
C2H4(g)+4H2O(g)ІЄH<0ЁЃЦфжаMЮЊКубЙШнЦїЃЌNЮЊКуШнШнЦїЃЌШєЮЌГжСНШнЦїЕФЮТЖШЯрЭЌЃЌдђЦНКтЪБЛьКЯЦјЬхЦНОљЯрЖдЗжзгжЪСПНЯДѓЕФЪЧ______ЃЈЬюЁАMЁБЛђЁАNЁБЃЉЁЃ
ЃЈ4ЃЉгУNaOHШмвКзіЬМВЖзНМСЃЌдкНЕЕЭЬМХХЗХЕФЭЌЪБвВЛёЕУСЫживЊЕФЛЏЙЄВњЦЗNa2CO3ЁЃГЃЮТЯТЃЌШєФГДЮВЖзНКѓЕУЕНpH=10ЕФШмвКЃЌдђШмвКжаc(![]() )ЁУc(
)ЁУc(![]() )=___________[K1(H2CO3)=4.4ЁС107ЁЂK2(H2CO3)=5ЁС1011]ЃЌШмвКжаc(Na+)_______ c(
)=___________[K1(H2CO3)=4.4ЁС107ЁЂK2(H2CO3)=5ЁС1011]ЃЌШмвКжаc(Na+)_______ c(![]() )+2c(
)+2c(![]() )ЃЈЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБЃЉЁЃ
)ЃЈЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБЃЉЁЃ
ЁОД№АИЁП58 kJЁЄmol1 < > ЮТЖШ K(A)=K(B)ЃОK(C) M 2ЉU1 >
ЁОНтЮіЁП
ЃЈ1ЃЉИљОнИЧЫЙЖЈТЩМЦЫуЃЛ
ЃЈ2ЃЉИљОнЮТЖШЖдЗДгІЫйТЪЕФгАЯьНтД№ЃЛИљОнбЙЧПЖдЦНКтзДЬЌЕФгАЯьХаЖЯЃЛ
ЃЈ3ЃЉЂйИљОнЮТЖШКЭбЙЧПЖдЦНКтзДЬЌКЭЦНКтГЃЪ§ЕФгАЯьЗжЮіНтД№ЃЛ
ЂкИљОнбЙЧПЖдЦНКтзДЬЌЕФгАЯьНсКЯЦНОљФІЖћжЪСПЕФКЌвхХаЖЯЃЛ
ЃЈ4ЃЉвРОнЕчРыГЃЪ§МЦЫуЃЛИљОнЕчКЩЪиКуЗжЮіНтД№ЁЃ
ЃЈ1ЃЉИљОнИЧЫЙЖЈТЩЃЌгУЂй+ЂкЪНМДПЩЕУЕНCO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ІЄH=58 kJЁЄmol1ЁЃ
CH3OH(g)+H2O(g) ІЄH=58 kJЁЄmol1ЁЃ
ЃЈ2ЃЉШнЦїAЁЂCжаСНжжЗДгІЮяЦ№ЪМСПЯрЭЌЃЌЦНКтЪБCШнЦїжаCH3OHЕФХЈЖШНЯAШнЦїжаЕФаЁЃЌЫЕУїCШнЦїжаЮТЖШНЯИпЃЌЦфЫќЬѕМўЯрЭЌЪБЃЌЮТЖШИпЗДгІЫйТЪНЯПьЃЌМДCШнЦїжаЗДгІЫйТЪНЯДѓЁЃAШнЦїжаCOЕФзЊЛЏТЪЮЊ80%ЃЌBШнЦїжаЗДгІПЩЪгЮЊНЋAШнЦїЬхЛ§бЙЫѕвЛАыЃЌМгбЙЪБгаРћгкЦНКте§ЯђвЦЖЏЃЌЙЪBШнЦїжаCOЕФзЊЛЏТЪДѓгк80%ЃЌД№АИЮЊЃК<ЃЛ>ЁЃ
ЃЈ3ЃЉЂйвђе§ЗДгІЗХШШЃЌЮТЖШдНИпH2ЕФЦНКтзЊЛЏТЪдНаЁЃЌЦНКтГЃЪ§дНаЁЃЌе§ЗДгІЪЧЦјЬхЗжзгЪ§ФПМѕаЁЕФЗДгІЃЌбЙЧПдНДѓЃЌH2ЕФЦНКтзЊЛЏТЪдНДѓЃЌЙЪXБэЪОЮТЖШЁЂYБэЪОбЙЧПЁЃгжKжЛгыЮТЖШгаЙиЃЌЙЪK(A)=K(B)ЃОK(C)ЃЌД№АИЮЊЃКЮТЖШЃЛK(A)=K(B)ЃОK(C)ЁЃ
Ђке§ЗДгІЪЧЦјЬхЗжзгЪ§ФПМѕаЁЕФЗДгІЃЌвђДЫЗДгІПЊЪМКѓЃЌNШнЦїжабЙЧПаЁгкMШнЦїжаЕФбЙЧПЃЛбЙЧПдНДѓдНгаРћгкЦНКтЯђгвНјааЃЌДяЕНЦНКтЪБШнЦїжаЦјЬхЗжзгЪ§ФПдНЩйЃЌЛьКЯЦјЬхЦНОљФІЖћжЪСПдНДѓЃЌД№АИЮЊЃКMЁЃ
ЃЈ4ЃЉгЩ![]() +H2O
+H2O![]()
![]() +OHЕУЃКKh=
+OHЕУЃКKh=![]() =KW/Ka2ЃЌДњШыгаЙиЪ§ОнКѓПЩЧѓГіc(
=KW/Ka2ЃЌДњШыгаЙиЪ§ОнКѓПЩЧѓГіc(![]() )ЁУc(
)ЁУc(![]() )=2ЁУ1ЁЃгЩЕчКЩЪиКудРэЕУЃКc(Na+)+c(H+)=c(
)=2ЁУ1ЁЃгЩЕчКЩЪиКудРэЕУЃКc(Na+)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH)ЃЌгЩгкc(OH)>c(H+)ЃЌЙЪc(Na+)>c(
)+c(OH)ЃЌгЩгкc(OH)>c(H+)ЃЌЙЪc(Na+)>c(![]() )+2c(
)+2c(![]() )ЃЌД№АИЮЊЃК2ЃК1ЃЛ>ЁЃ
)ЃЌД№АИЮЊЃК2ЃК1ЃЛ>ЁЃ

 аЁЬьВХПЮЪБзївЕЯЕСаД№АИ
аЁЬьВХПЮЪБзївЕЯЕСаД№АИ вЛПЮЫФСЗЯЕСаД№АИ
вЛПЮЫФСЗЯЕСаД№АИ ЛЦИдаЁзДдЊТњЗжГхДЬЮЂВтбщЯЕСаД№АИ
ЛЦИдаЁзДдЊТњЗжГхДЬЮЂВтбщЯЕСаД№АИ аТИЈНЬЕМбЇЯЕСаД№АИ
аТИЈНЬЕМбЇЯЕСаД№АИЁОЬтФПЁПФПЧАЙЄвЕЩЯПЩРћгУCOЛђCO2РДЩњВњШМСЯМзДМЃЌФГбаОПаЁзщЖдЯТСагаЙиМзДМжЦШЁЕФШ§ЬѕЛЏбЇЗДгІдРэНјааЬНОПЁЃвбжЊдкВЛЭЌЮТЖШЯТЕФЛЏбЇЗДгІЦНКтГЃЪ§(K1ЁЂK2ЁЂK3)ШчЯТБэЫљЪОЃК
ЛЏбЇЗДгІ | ьЪБф | ЦНКтГЃЪ§ | ЮТЖШ/Ёц | ||
500 | 700 | 800 | |||
Ђй2H2(g)ЃЋCO(g) | ІЄH1 | K1 | 2.5 | 0.34 | 0.15 |
ЂкCO2(g)ЃЋH2(g) | ІЄH2 | K2 | 1.0 | 1.70 | 2.52 |
ЂлCO2(g)ЃЋ3H2(g) | ІЄH3 | K3 | |||
ЧыЛиД№ЯТСаЮЪЬтЃК
(1)ЗДгІЂкЪЧ________(ЬюЁАЮќШШЁБЛђЁАЗХШШЁБ)ЗДгІЁЃ
(2)ИљОнЗДгІЂйгыЂкПЩЭЦЕМГіK1ЁЂK2гыK3жЎМфЕФЙиЯЕЃЌдђK3ЃН________(гУK1ЁЂK2БэЪО)ЃЛИљОнЗДгІЂлХаЖЯІЄS___0(ЬюЁА>ЁБЁЂЁАЃНЁБЛђЁА<ЁБ)ЃЌдк______(ЬюЁАНЯИпЁБЛђЁАНЯЕЭЁБ)ЮТЖШЯТгаРћгкИУЗДгІздЗЂНјааЁЃ
(3)500ЁцЪБЃЌВтЕУЗДгІЂлдкФГЪБПЬЃЌCO2(g)ЁЂH2(g)ЁЂCH3OH(g)ЁЂH2O(g)ЕФХЈЖШЗжБ№ЮЊ0.1mol/LЁЂ0.8mol/LЁЂ0.3mo/LЁЂ0.15mol/LЃЌдђДЫЪБvе§________vФц(ЬюЁА>ЁБЁЂЁАЃНЁБЛђЁА<ЁБ)ЁЃ