题目内容
【题目】合成导电高分子材料PPV的反应如下。下列说法正确的是( )
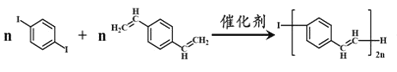 +(2n-1)HI
+(2n-1)HI
A.合成PPV的反应为加聚反应
B.1molPPV最多能与4 molH2发生加成反应
C. 与溴水加成后的产物最多有16个原子共平面
与溴水加成后的产物最多有16个原子共平面
D.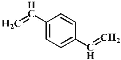 和苯乙烯互为同系物
和苯乙烯互为同系物
【答案】C
【解析】
A. 含有不饱和键的有机物通过加成生成高分子化合物的反应属于加聚反应,合成PPV通过缩聚反应生成,同时有小分子物质![]() 生成,不属于加聚反应,故A错误;
生成,不属于加聚反应,故A错误;
B. PPV为高分子化合物,含有n个链节,则1mol PPV最多能与4n mol![]() 发生加成反应,故B错误;
发生加成反应,故B错误;
C. 能与溴水发生加成反应的为碳碳双键,加成得到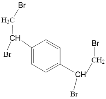 ,与苯环直接相连的原子在同一个平面上,结合单键可以旋转,则最多有16个原子共平面,故C正确;
,与苯环直接相连的原子在同一个平面上,结合单键可以旋转,则最多有16个原子共平面,故C正确;
D. 含有两个碳碳双键,与苯乙烯结构不同,不是同系物,故D错误;
故选:C。

【题目】已知H2O2分解速率受多种因素影响,某小组对此进行探究,得到如下结果。下列说法不正确的是
序号 | H2O2体积(ml) | FeCl3体积(ml) | 混合溶液pH | 纯H2O2pH | 分解完全时间(s) |
1 | 20 | 10 | 1.00 | 2.92 | 几乎不分解 |
2 | 20 | 10 | 2.92 | 2.92 | 202 |
3 | 20 | 10 | 7.50 | 2.92 | 192 |
4 | 20 | 10 | 9.50 | 2.92 | 139 |
5 | 20 | 10 | 10.50 | 2.92 | 77 |
表1 (200C) | |||||
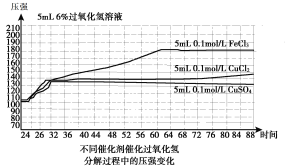
图1(200C)
A.表1表明,其他条件相同时,碱性条件下H2O2分解速率快于酸性条件下
B.图1表明,其他条件相同时,铜盐对H2O2分解的催化效果好于铁盐
C.图1表明,其他条件相同时,CuCl2对H2O2分解的催化效果好于CuSO4
D.以上实验表明,催化剂、溶液酸碱性对H2O2分解速率都有影响
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为___________________________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)===2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?________(填“能”或“否”),依据是_________________________________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
①甲酸钠的水溶液呈碱性,请用离子方程式表示其原因________________________________________。
②向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_________________________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。


