题目内容
【题目】某兴趣小组的同学设计实验制备CuBr(白色结晶性粉末,微溶于水,不溶于乙醇等有机溶剂),实验装置(夹持、加热仪器略)如图所示。
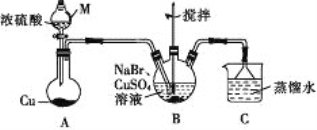
(1)若将M中的浓硫酸换成70%的H2SO4,则圆底烧瓶中的固体试剂为____(填化学式)。
(2)B中发生反应的化学方程式为_____,能说明B中反应已完成的依据是_____。若B中Cu2+仍未完全被还原,适宜加入的试剂是____(填标号)。
A.液溴 B.Na2SO4 C.铁粉 D.Na2S2O3
(3)下列关于过滤的叙述不正确的是___(填标号)。
a.漏斗末端颈尖可以不紧靠烧杯壁 b.将滤纸润湿,使其紧贴漏斗内壁
c.滤纸边缘可以高出漏斗口 d.用玻璃棒在漏斗中轻轻搅动以加快过滤速率
(4)洗涤时,先用装置C中的吸收液清洗,其目的是______,再依次用溶解SO2的乙醇、乙醚洗涤的目的是______。
【答案】Na2SO3 2CuSO4+2NaBr+SO2+2H2O=2CuBr↓+Na2SO4+2H2SO4 溶液蓝色褪去 D acd 防止CuBr被氧化 用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥
【解析】
(1)装置A中,Cu与浓硫酸反应制取二氧化硫,70%的H2SO4可与Na2SO3固体反应生成二氧化硫;
(2)由题知B装置中硫酸铜、溴化钠、水和SO2反应生成CuBr,铜元素被二氧化硫还原,SO2自身被氧化为SO42,据此写出方程式;硫酸铜溶液显蓝色,实验完成时蓝色的铜离子全部转化为CuBr;Na2S2O3与生成的硫酸反应可生成二氧化硫,继续还原Cu2+;
(3)a. 漏斗末端颈尖要紧靠烧杯内壁,防止液体溅出,故错误;
b. 将滤纸润湿,使其紧贴漏斗内壁,防止存在气泡,保证过滤顺利进行;
c. 滤纸边缘要低于漏斗口,防止滤液渗出造成滤液损失;
d. 用玻璃棒在漏斗中轻轻搅动,容易使滤纸破损;
(4)装置C中的吸收液含有SO2,根据SO2的还原性分析;再依次用溶解SO2的乙醇、乙醚洗涤的目的是用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥。
(1)装置A中,Cu与浓硫酸反应制取二氧化硫,70%的H2SO4可与Na2SO3固体反应生成二氧化硫;
故答案为:Na2SO3;
(2)由题知B装置中硫酸铜、溴化钠、水和SO2反应生成CuBr,铜元素被二氧化硫还原,SO2自身被氧化为SO42,发生反应的化学方程式为2CuSO4+2NaBr+SO2+2H2O=2CuBr↓+Na2SO4+2H2SO4;硫酸铜溶液显蓝色,实验完成时蓝色的铜离子全部转化为CuBr,则能说明B中反应已完成的依据是溶液蓝色褪去;Na2S2O3与生成的硫酸反应可生成二氧化硫,继续还原Cu2+;
故答案为:2CuSO4+2NaBr+SO2+2H2O=2CuBr↓+Na2SO4+2H2SO4;溶液蓝色褪去;D;
(3)a. 漏斗末端颈尖要紧靠烧杯内壁,防止液体溅出,故错误;
b. 将滤纸润湿,使其紧贴漏斗内壁,防止存在气泡,保证过滤顺利进行,故正确;
c. 滤纸边缘要低于漏斗口,防止滤液渗出造成滤液损失,故错误;
d. 用玻璃棒在漏斗中轻轻搅动,容易使滤纸破损,故错误;
故答案为:acd;
(4)装置C中的吸收液含有SO2,溴化亚铜易被氧化,SO2有还原性,可以防止CuBr被氧化;再依次用溶解SO2的乙醇、乙醚洗涤的目的是用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥;
故答案为:防止CuBr被氧化;用乙醇除去固体表面的水,再用更易挥发的乙醚除去乙醇,使其快速干燥。

 名校课堂系列答案
名校课堂系列答案【题目】前四周期主族元素X、Y、M、N的信息如下:
有关信息 | |
X | X元素的原子最外层电子数是电子层数的3倍 |
Y | Y元素所在主族序数与周期序数之差为4,Y是同周期中原子半径最小的元素 |
M | 常温下单质呈液态的非金属元素 |
N | N的化合物在灼烧时焰色呈黄色 |
请回答下列问题:
(1)M元素在周期表中的位置______________________。
(2)Y元素的简单阴离子结构示意图_______________。
(3)化合物N2X2的电子式为_______________,试写出它的一种用途_______________。
(4)设计方案证明M、Y元素的得电子能力强弱:______________________________________。
(5)Y的单质是一种重要的化工原料,在工农业生产、生活中有着重要的应用。为探究Y单质的性质,某同学设计了如图所示的实验装置。
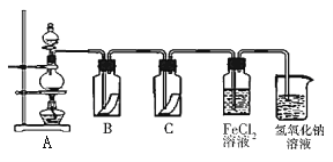
①实验中制取气体的化学方程式为:__________________________________________,该反应中氧化剂和还原剂的物质的量之比为_________________________
②装置B、C中依次放的是干燥的红色布条和湿润的红色布条,理论上装置_____中的红色布条褪色,但实验过程中该同学发现装置B、C中的布条均褪色,其原因可能是_________________。
③写出该气体与FeCl2溶液反应的离子方程式____________________________________。
④工业上常用石灰乳吸收制该气体制得漂白粉,漂白粉的必须密封保存,否则易失效,原因是____(用化学方程式表示)。
【题目】元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是六种短周期元素的原子半径及主要化合价(已知铍元素的原子半径为0.089 nm)。
元素代号 | A | B | C | D | X | Y |
原子半径/nm | 0.037 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +3 | +6,-2 | -1 | -2 | +5,-3 |
(1)C元素在周期表中的位置为________,其离子结构示意图为:_______。
(2)B的最高价氧化物对应的水化物与Y的最高价氧化物对应的水化物反应的离子方程式为___。
(3)关于C、D 两种元素说法正确的是__________(填序号)。
a.简单离子的半径D>C b.气态氢化物的稳定性D比C强 c.最高价氧化物对应的水化物的酸性C比D强
(4)在100mL18mol/L的C的最高价氧化物对应的水化物的浓溶液中加入过量的铜片,加热使其充分反应,产生气体的体积为6.72L(标况下),则该反应过程中转移的电子数为______。
(5)写出由A、D、X三种元素组成的某种可以消毒杀菌物质的电子式_____________。
(6)比较Y元素与其同族短周期元素的氢化物的熔沸点高低__ >___ (填氢化物化学式),理由___________。