题目内容
【题目】前四周期主族元素X、Y、M、N的信息如下:
有关信息 | |
X | X元素的原子最外层电子数是电子层数的3倍 |
Y | Y元素所在主族序数与周期序数之差为4,Y是同周期中原子半径最小的元素 |
M | 常温下单质呈液态的非金属元素 |
N | N的化合物在灼烧时焰色呈黄色 |
请回答下列问题:
(1)M元素在周期表中的位置______________________。
(2)Y元素的简单阴离子结构示意图_______________。
(3)化合物N2X2的电子式为_______________,试写出它的一种用途_______________。
(4)设计方案证明M、Y元素的得电子能力强弱:______________________________________。
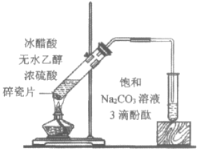
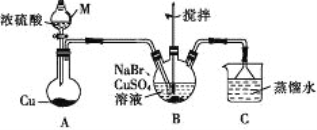
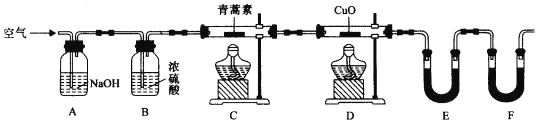
(5)Y的单质是一种重要的化工原料,在工农业生产、生活中有着重要的应用。为探究Y单质的性质,某同学设计了如图所示的实验装置。
①实验中制取气体的化学方程式为:__________________________________________,该反应中氧化剂和还原剂的物质的量之比为_________________________
②装置B、C中依次放的是干燥的红色布条和湿润的红色布条,理论上装置_____中的红色布条褪色,但实验过程中该同学发现装置B、C中的布条均褪色,其原因可能是_________________。
③写出该气体与FeCl2溶液反应的离子方程式____________________________________。
④工业上常用石灰乳吸收制该气体制得漂白粉,漂白粉的必须密封保存,否则易失效,原因是____(用化学方程式表示)。
【答案】第四周期第VIIA族 
![]() 供氧剂或漂白剂 取NaBr溶液少许于试管中,滴加氯水,振荡,然后滴入CCl4,振荡静置,观察到液体分层,下层呈橙色 MnO2+4HCl(浓)
供氧剂或漂白剂 取NaBr溶液少许于试管中,滴加氯水,振荡,然后滴入CCl4,振荡静置,观察到液体分层,下层呈橙色 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 1:2 C Cl2中可能混有少量的水蒸气 2Fe2++Cl2=2Fe3++2Cl﹣ Ca(ClO)2+CO2+H2O=CaCO3+2HClO,2HClO
MnCl2+Cl2↑+2H2O 1:2 C Cl2中可能混有少量的水蒸气 2Fe2++Cl2=2Fe3++2Cl﹣ Ca(ClO)2+CO2+H2O=CaCO3+2HClO,2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
(1)X元素的原子最外层电子数是电子层数的3倍,则X核外电子排布是2、6,X是O元素;
(2) Y元素所在主族序数与所在周期序数之差为4,Y是同周期中原子半径最小的元素,则Y是Cl元素;
(3)常温下M单质是呈液态的非金属元素,则M是Br元素;
N的化合物在灼烧时焰色呈黄色,故N为Na元素,以此解答该题。
根据上述分析可知:X是O,Y是Cl,M是Br,N是Na元素。
(1)M是Br元素,原子核外电子排布是2、8、18、7,位于元素周期表第四周期第ⅦA族;
(2)Y为Cl,Cl元素的简单阴离子Cl-是Cl原子得到1个电子形成的阴离子,最外层满足8个电子的稳定结构,共有3个电子层,Cl-的结构示意图为: ;
;
(3)X是O,N是Na元素,则N2X2是Na2O2,该化合物是离子化合物,Na+与O22-通过离子键结合,O22-中2个O原子之间通过共价键结合,其电子式为:![]() ;该物质与H2O、CO2反应产生氧气,因此常用作呼吸面具的供氧剂;由于其具有强的氧化性,能够将有色物质氧化变为无色物质,也常作漂白剂;
;该物质与H2O、CO2反应产生氧气,因此常用作呼吸面具的供氧剂;由于其具有强的氧化性,能够将有色物质氧化变为无色物质,也常作漂白剂;
(4)元素的非金属性:Cl>Br,元素的非金属性越强,其单质的氧化性就越强,活动性强的可以将活动性弱的置换出来,因此可以把少量氯滴入到NaBr溶液中,振荡,然后加入CCl4,振荡,若液体分层,下层呈橙色,就证明发生反应:Cl2+2NaBr=2NaCl+Br2,说明Cl元素得到电子的能力比Br元素强;
(5)①在A中浓盐酸与MnO2混合加热,发生反应制取氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,在该反应中MnO2为氧化剂,HCl为还原剂,1 mol MnO2反应消耗4 mol HCl,其中2 mol HCl被氧化,做还原剂,失去电子变为Cl2,另外2 mol HCl其酸的作用,反应后与Mn2+结合为MnCl2,故该反应中氧化剂和还原剂的物质的量之比为1:2;
MnCl2+Cl2↑+2H2O,在该反应中MnO2为氧化剂,HCl为还原剂,1 mol MnO2反应消耗4 mol HCl,其中2 mol HCl被氧化,做还原剂,失去电子变为Cl2,另外2 mol HCl其酸的作用,反应后与Mn2+结合为MnCl2,故该反应中氧化剂和还原剂的物质的量之比为1:2;
②干燥的氯气不具有漂白性,潮湿的氯气中氯气与水反应产生的HClO具有漂白性,因此能够使有色物质褪色。在装置B、C中依次放的是干燥的红色布条和湿润的红色布条,理论上装置C中的红色布条褪色,但实验过程中该同学发现装置B、C中的布条均褪色,其原因可能是Cl2中可能混有少量的水蒸气,Cl2与H2O反应产生了具有漂白作用的HClO;
③Cl2具有强的氧化性,可以将Fe2+氧化产生Fe3+,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl﹣;
④漂白粉的有效成分是Ca(ClO)2,由于酸性:H2CO3>HClO,漂白粉会与空气中CO2及H2O发生反应:Ca(ClO)2+CO2+H2O=CaCO3+2HClO,反应产生的HClO不稳定,光照分解产生HCl、O2,反应方程式为:2HClO![]() 2HCl+O2↑,因此漂白粉必须密封保存在阴暗处,否则易失效。
2HCl+O2↑,因此漂白粉必须密封保存在阴暗处,否则易失效。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验所得结论正确的是
① | ② | ③ | ④ |
|
|
|
|
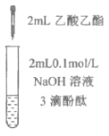
充分振荡试管,下层溶液红色褪去 | 溶液变红 | 溶液变红 | 充分振荡右侧小试管, 下层溶液红色褪去 |
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH![]() CH3COONa+C2H5OH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O![]() CH3COOH+H+
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸