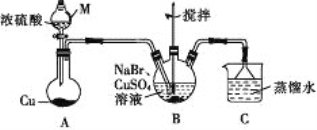
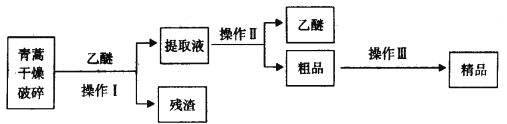
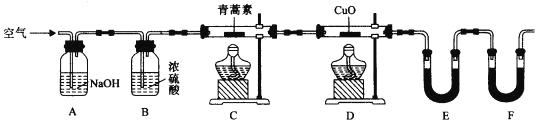
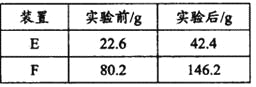
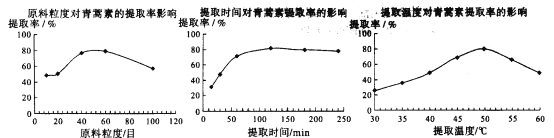
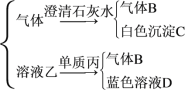题目内容
【题目】第ⅢA族元素及某些常见非金属元素的化合物在晶体材料等方面的用途非常广泛。回答下列问题:
(1)写出基态Ga原子的价电子轨道表示式__________________
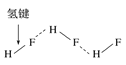
(2)NH4HF2中HF2-的结构为F-H···F-,则NH4HF2中含有的化学键有_________
A.离子键 B.共价键 C.金属键 氢键 E.配位键
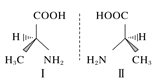
(3)CH3OH分子中的键角:H-C-H_______H-O-C。(填“<”、“>”、“=”)
(4)B、Al、Ga单质的熔点依次为2300°C,660°C,29.8°C,解释熔点产生差异的原因:___________________
(5)黑磷是磷的一种同素异形体,与石墨烯类似,其晶体结构片段如图所示:其中最小的环为____元环,每个环平均含有____个P原子。

(6)铊化钠(NaTl)可看作是由两个金刚石晶格穿插得到的(如图),已知晶胞参数为a pm。
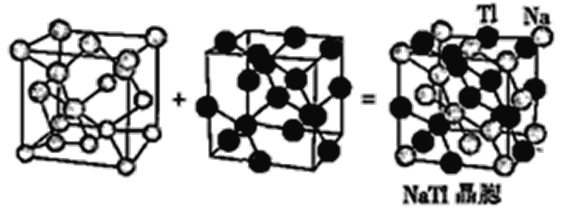
①铊化钠中Tl-Tl间最小距离为__________pm。
②设阿伏加德罗常数的值为NA,则NaTl的密度是________g·cm-3(列出计算表达式)。
【答案】![]() 1 ABE > 硼单质是原子晶体,熔点高,Al、Ga均为金属,且位于同主族,Al、Ga的价电子数相同,Al的原子半径较小,则金属键较强,熔点较高 六 2
1 ABE > 硼单质是原子晶体,熔点高,Al、Ga均为金属,且位于同主族,Al、Ga的价电子数相同,Al的原子半径较小,则金属键较强,熔点较高 六 2 ![]()
![]()
【解析】
(1)Ga原子位于第四周期,第IIIA族,最外层3个电子,结合构造原理写出其价电子的轨道表示式;
(2)根据已知信息可知,NH4+与HF2-形成离子键,HF2-中F与H原子之间存在极性键、氢键,NH4+中含有配位键,氢键不属于化学键;
(3)先判断甲醇分子中C、O原子的σ键电子对数、孤电子对数,并判断其杂化方式,再结合孤对电子之间的排斥力>孤对电子对成键电子对的排斥力>成键电子对之间的排斥力,判断H-C-H、H-O-C键角的大小关系;
(4)硼单质是原子晶体,Al、Ga均为金属晶体,根据晶体熔沸点的比较方法分析原因;
(5)观察黑磷晶体结构片段可知,最小的环为六元环,根据均摊法判断每个环平均含有的P原子个数;
(6)①由已知信息,铊化钠(NaTl)可看作是由两个金刚石晶格穿插得到,晶胞中,体对角线的距离为![]() ,铊化钠中Tl-Tl间的最小距离为体对角线的
,铊化钠中Tl-Tl间的最小距离为体对角线的 ![]() ;
;
②一个晶胞中含有8个Na原子,8个Tl原子,先计算晶胞质量,再计算晶胞的体积,进而计算其密度。
(1)Ga原子位于第四周期,第IIIA族,最外层3个电子,基态Ga原子的价电子轨道表示式为![]() ;
;
故答案为: ![]() ;
;
(2)NH4+与HF2-形成离子键,HF2-中F与H原子之间存在极性键、氢键,NH4+中含有配位键,氢键不属于化学键;
故答案为:ABE;
(3)CH3OH分子中碳原子没有孤电子对数,形成4个σ键,C原子杂化轨道数目为4,C原子采取sp3杂化;O原子有2对孤电子对,形成2个σ键,O原子杂化轨道数目=2+2=4,O原子采取sp3杂化,它们的VSEPR模型均为四面体形,由于孤对电子之间的排斥力>孤对电子对成键电子对的排斥力>成键电子对之间的排斥力,故键角H-C-H>H-O-C;
故答案为:>;
(4)B是非金属,硼单质是原子晶体,共价键强度大,熔点高,Al、Ga均为金属,且位于同主族,Al、Ga的价电子数相同,Al的原子半径较小,则金属键较强,熔点较高;
故答案为:硼单质是原子晶体,熔点高,Al、Ga均为金属,且位于同主族,Al、Ga的价电子数相同,Al的原子半径较小,则金属键较强,熔点较高;
(5)观察黑磷晶体结构片段可知,最小的环为六元环,每个环有6个P原子,但每个P原子被3个环共用,则每个环平均含有![]() 个P原子;
个P原子;
故答案为:六;2;
(6)①由已知信息,铊化钠(NaTl)可看作是由两个金刚石晶格穿插得到,晶胞中,体对角线的距离为![]() ,铊化钠中Tl-Tl间的最小距离为体对角线的
,铊化钠中Tl-Tl间的最小距离为体对角线的 ![]() ,则为
,则为![]() ;
;
故答案为:![]() ;
;
②一个晶胞中含有8个Na原子,8个Tl原子,则晶胞质量为,体积为
![]() ,则NaTl的密度为
,则NaTl的密度为![]() ;
;
故答案为:![]() 。
。

【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是_______________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是___________________________________。