题目内容
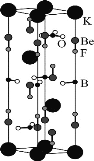
【题目】四硼酸钠的阴离子Xm-(含B、O、H三种元素)的球棍模型如图所示。下列说法错误的是( )
A.元素的第一电离能:O>H>B
B.在Xm-中,硼原子轨道的杂化类型有sp2和sp3
C.配位键存在于4、5原子之间和4、6原子之间
D.m=2,NamX的化学式为Na2B4O5(OH)4
【答案】C
【解析】
A.同周期元素,从左向右,第一电离能逐渐增大(IIA、VA反常),故O>B;H只有一个电子,原子半径很小,其1s是半满结构,较稳定,第一电离比B大,因此H>B,故三种元素的第一电离能:O>H>B,A正确,不选;
B.如图,2号B形成3个键,则B原子为sp2杂化,4号B形成4个键,则B原子为sp3杂化,B正确,不选;
C.根据图知,B原子价层电子对个数是3的采用sp2杂化、是4的采用sp3杂化;含有空轨道的原子和含有孤电子对的原子之间易形成配位键;4号B形成4个键,其中1个键是配位键,B原子含有空轨道、O原子含有孤电子对,5号O原子连接的是H原子,孤电子对容易提供出来,故4、5原子之间存在配位键,而4、6原子之间是共价键,C错误,符合题意;
D.观察模型,可知Xm-是(H4B4O9)m-,依据化合价H为+1,B为+3,O为-2,可得m=2,从图中可以看出4个H原子都是羟基氢,故NamX的化学式为Na2B4O5(OH)4,D正确,不选。
答案选C。

练习册系列答案
相关题目