题目内容
13.有一包白色固体粉末,可能含有Na2SO4、CaCO3、KCl、BaCl2、CuSO4中的一种或几种,按以下步骤进行实验:①将固体粉末溶于水得无色溶液和白色沉淀;
②加入足量稀盐酸,沉淀部分溶解且有气泡产生.
根据以上实验所产生的现象,判断这种混合物里,一定含有Na2SO4、CaCO3、BaCl2物质,一定没有CuSO4物质,可能有的物质是KCl.
写出上述所发生反应的离子方程式:Ba2++SO42-═BaSO4↓、CaCO3+2H+=Ca2++H2O+CO2↑.
分析 ①将固体粉末溶于水得无色溶液和白色沉淀,溶液为无色,说明一定不存在蓝色的CuSO4;有白色沉淀,可能含有碳酸钙或硫酸钠、氯化钡;
②加入稀盐酸,沉淀部分溶解且有气泡产生,沉淀只有部分溶解,说明沉淀为碳酸钙和硫酸钡,溶液中一定存在Na2SO4、CaCO3、BaCl2;
根据以上分析判断未知物的组成,然后写出反应的离子方程式.
解答 解:根据①可知,一定不存在溶液有色的CuSO4;根据②有气体生成、沉淀部分溶解可知,气体为二氧化碳,白色固体中一定存在CaCO3、Na2SO4、BaCl2,无法确定是否含有KCl,
根据以上分析可知,原白色固体中一定含有:Na2SO4、CaCO3、BaCl2;一定不含CuSO4;可能含有KCl;
发生反应的离子方程式有:Ba2++SO42-═BaSO4↓、CaCO3+2H+=Ca2++H2O+CO2↑,
故答案为:Na2SO4、CaCO3、BaCl2;CuSO4;KCl;Ba2++SO42-═BaSO4↓、CaCO3+2H+=Ca2++H2O+CO2↑.
点评 本题考查了未知物的检验,题目难度中等,明确常见物质的性质及检验方法为解答关键,注意掌握某些物质具有的特殊性:如硫酸铜溶液为有色溶液、氢氧化铁为红褐色沉淀、氢氧化铜为氯水沉淀、二氧化氮为红棕色气体等,常常为解答该类题的突破口.

练习册系列答案
相关题目
3.常温下将氯化铵固体溶解在D2O(重水)中,下列有关水解的离子方程式或等式中正确的是( )
| A. | NH${\;}_{4}^{+}$+D2O?NH3•D2O+H+ | B. | NH${\;}_{4}^{+}$+D2O?NH3•HDO+D+ | ||
| C. | c(OD-)•c(H+)=Kw | D. | c(OH-)•c(D+)=Kw |
4.一种碳纳米管能够吸附氢气,可做二次电池的碳电极(如图所示),该电池的电解质溶液是6mol/L溶液,下列说法中,错误的是( )
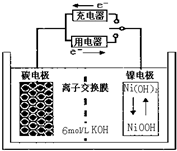

| A. | 充电时碳电极上发生还原反应 | |
| B. | 充电时Ni电极与电源的正极相连 | |
| C. | 放电时碳电极反应为H2-2e-=2H+ | |
| D. | 放电时Ni电极反应为Na(OH)+H2O+e-=Ni(OH)2+OH- |
1.化学与社会、生产、生活紧密相关.下列说法不正确的是( )
| A. | 往淡水中加入NaCl等配成人造海水,可用于海产品的长途运输 | |
| B. | 氢氧化镁分解时吸收大量热量,可添加到合成树脂中做阻燃剂 | |
| C. | 酒精能使蛋白质变性,无水酒精在医学上常被用于消毒 | |
| D. | 利用粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程 |
8.除去下列物质中的杂质选用的试剂和方法最合理的是( )
| 物质 | 杂质 | 试剂 | 方法 | |
| A | 甲烷 | 乙烯 | 酸性高锰酸钾溶液 | 洗气 |
| B | 氯化亚铁溶液 | 氯化铁 | 过量铁粉 | 过滤 |
| C | 苯 | 溴 | 足量NaI溶液 | 分液 |
| D | 乙酸乙酯 | 乙酸 | 饱和碳酸钠溶液 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
18.已知I2易溶于有机溶剂中,现欲从碘水中萃取出I2,下列溶剂不能作为萃取剂的是( )
| A. | 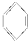 | B. | CCl4 | C. | 酒精 | D. | 氯仿 |
5.在T℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示.下列说法中不正确的是( ) 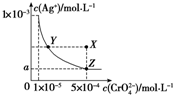

| A. | T℃时,在Y点和Z点,Ag2CrO4的Ksp相等 | |
| B. | 向饱和AgCrO4溶液中加入固体K2CrO4不能使溶液由Y点变为X点 | |
| C. | T℃时,Ag2CrO4的Ksp为1×10-8 | |
| D. | 图中a=$\sqrt{2}$×10-4 |
2.下列是对一些分子中共价键的描述,其中不正确的是( )
| A. | HCl分子中的共价键是由H原子的1s轨道和Cl原子未成对电子的3p轨道形成的s-pσ键 | |
| B. | 石墨晶体中碳原子的杂化轨道类型为sp2,碳原子间只存在sp2-sp2σ键 | |
| C. | H2O分子中的共价键是由O原子的sp3杂化轨道和H原子的s轨道形成的s-sp3σ键 | |
| D. | N2分子中的共价键是由2个N原子各自用3个p轨道形成的3个p-pπ键 |
