��Ŀ����
����Ŀ����Ԫ�صĵ��ʼ��仯����������������Ӧ�ü���㷺�������������գ�
������������̽��
�����ͼʵ��װ�����Ʊ�����֤���������ʣ����ּг�װ��δ��������
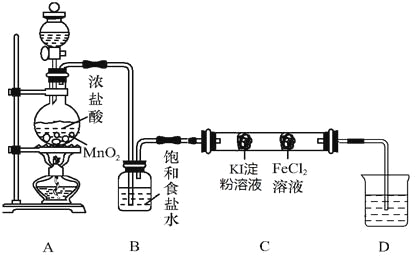
��1��A�з��ù���������̵�װ��������___________________��
��2��װ��B��������___________________��
��3��Ӳ�ʲ�����C������װ������մ������Լ���������������ʵ������Ϊ ��
��4��D�е�NaOH��Һ��������β������Ӧ���D�м�������ϡ�����������壬д���÷�Ӧ�����ӷ���ʽ ��
�����Ʊ�HClO
��5�����װ��E������ͼ��װ��C�������Ʊ��ϸ�Ũ�ȵ�HClO��Һ����Բ����ƿ�ײ�����һ����������ס�Ĺ�����״̼��ơ�
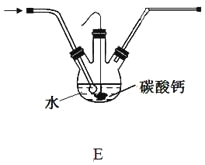
���÷��������Ƶýϸ�Ũ��HClO��ԭ���ǣ���ϱ�Ҫ�Ļ�ѧ���Իش� ��
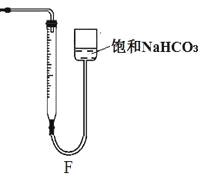
����Ӧ��������������ʣ���ʯ��ʯ���Һ�棬���õ���Һ��ϡ�����ϣ�������������CO2���壬��Ӧ������Һ�е����ʳ�HClO�⣬������ �� ��д���ָ��εĻ�ѧʽ��һ�����Σ�һ����ʽ�Σ�����С��ͬѧ��÷�Ӧ��̼�����������M g����Ӧ������õ�200mL��Һ��ȡ��10mL������ϡ�����ϣ�����Fװ�ò�ò������������ΪV L���ѻ���ɱ�״��������ԭ��Һ�к������ε�Ũ��Ϊ mol��L��1���ú�M��V�Ĵ���ʽ��ʾ����
���𰸡���1��Բ����ƿ��
��2����ȥCl2�е�HCl��
��3������ɫ��
��4��ClO-+Cl-+2H+=Cl2��+H2O��
��5����Cl2+H2O![]() H++Cl-+HClO��̼�����H+��Ӧ��ʹƽ�������ƶ���HClOŨ������
H++Cl-+HClO��̼�����H+��Ӧ��ʹƽ�������ƶ���HClOŨ������
��CaCl2Ca��HCO3��2M/20��V/0.448��
�����������������������װ�õ�Ŀ���ǽ����������ʵ�̽����AΪ�������Ʊ�װ�ã�BΪ�����ľ���װ�ã�CΪ����̽����װ�ã�DΪβ������װ�á���1��A�з��ù���������̵�װ����Բ����ƿ����2��װ��B�������dz�ȥ�����л��е�HCl���ʡ���3��Ӳ�ʲ�����C��������KI����ΪI2�������۱���ɫ����4��D�е�NaOH��Һ��������β������Ӧ�����Һ�к����Ȼ��ƺʹ������ƣ���������ϡ����ᷢ�����з�Ӧ������������Ӧ�����ӷ���ʽΪClO-+Cl-+2H+= Cl2��+H2O��
������5����������ˮ�д����ܽ�ƽ��Cl2+ H2O![]() H+ + Cl- + HClO�����Ʊ�HClOʱ������̼�������H+��Ӧ��ʹƽ�������ƶ���HClOŨ����������ԭ��ˮ�д���HCl��HClO��HCl��̼��Ʒ�Ӧ����CaCl2�����õ���Һ��ϡ�����ϣ�������������CO2���壬˵����Һ�к�����Ca��HCO3��2����Ӧ��̼�����������M g�����ʵ���Ϊ
H+ + Cl- + HClO�����Ʊ�HClOʱ������̼�������H+��Ӧ��ʹƽ�������ƶ���HClOŨ����������ԭ��ˮ�д���HCl��HClO��HCl��̼��Ʒ�Ӧ����CaCl2�����õ���Һ��ϡ�����ϣ�������������CO2���壬˵����Һ�к�����Ca��HCO3��2����Ӧ��̼�����������M g�����ʵ���Ϊ![]() mol������ݸ�Ԫ���غ㣬���ɵ�CaCl2��Ca��HCO3��2�������ʵ���Ϊ
mol������ݸ�Ԫ���غ㣬���ɵ�CaCl2��Ca��HCO3��2�������ʵ���Ϊ![]() mol����Ӧ������õ�200mL��Һ��ȡ��10mL������ϡ�����ϣ�Fװ�ò�ò�����CO2���ΪV L�����ʵ���Ϊ
mol����Ӧ������õ�200mL��Һ��ȡ��10mL������ϡ�����ϣ�Fװ�ò�ò�����CO2���ΪV L�����ʵ���Ϊ![]() mol����200mL��Һ��Ca��HCO3��2�����ʵ���Ϊ
mol����200mL��Һ��Ca��HCO3��2�����ʵ���Ϊ![]() ��20��
��20��![]() =
=![]() mol������CaCl2�����ʵ���Ϊ��
mol������CaCl2�����ʵ���Ϊ��![]() ��
��![]() ��mol����ԭ200mL��Һ�к������ε�Ũ��Ϊ��
��mol����ԭ200mL��Һ�к������ε�Ũ��Ϊ��![]() ��
��![]() ��mol��L��1��
��mol��L��1��

����Ŀ��Ϊ̽��ͭ��ϡ���ᷴӦ�IJ��PӰ�췴Ӧ���ʵ���Ҫ���أ���������ʵ�顣
ʵ��һ ̽��ͭ��ϡ���ᷴӦ�IJ���ʵ��װ����ͼ��ʾ���������Ѽ�顣

��֪��FeSO4��NO===[Fe(NO)]SO4���÷�Ӧ�ϻ�����������һ����[Fe(NO)]2��ʱͻ������
��ɫ��
(1)ʵ�鿪ʼʱ�Ƚ�Y���Թ���ʢ��̼��Ƶ�֧����б����������ϡ���ᣬ��ʵ�������Ŀ����___________________________________________________________��
(2)ͭƬ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ____________________________________��
(3)��ʵ��A���ɵ������У�����NO2����B��ʵ������Ϊ__________________��
��ֻ��NO���ɣ���B��ʵ��������_________________��
ʵ��� ̽����ѧ��Ӧ����Է�Ӧ���ʵ�Ӱ��
�������ʵ�飬������ͼװ�òⶨ��Һͻ��������ɫ��ʱ�䡣
��� | �¶� | ͭƬ/(g) | ����/mL | ����ͭ/g |
1 | 25 �� | �� | �� | �� |
2 | 25 �� | 5 | 20 | 0.5 |
3 | 25 �� | 5 | 20 | 1.0 |
(4)�뽫�ϱ���ʵ��1��ʵ��������д������
��________����________����________��
(5)ͨ��ʵ�鷢��ʵ��1��2��3�ķ�Ӧ���ʲ������Ա仯��Ϊ�ﵽʵ��Ŀ�Ļ���Ҫ�������е�ʵ����_______________________________________________________��

