题目内容
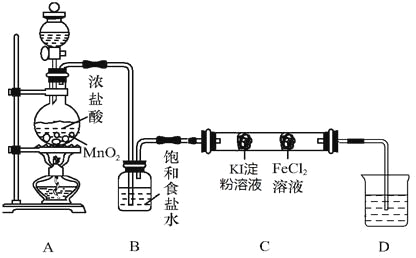
【题目】Ⅰ.已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
(1)上述反应中被氧化的元素是_______;还原产物是_____________
(2)氧化剂与还原剂的物质的量之比是________________________
(3)上述反应中KMnO4、HCl(浓)、MnCl2、 Cl2四中微粒氧化性由强到弱的顺序为:_________________________________________
(4)标明该反应电子转移方向和数目:_______________________________________
Ⅱ.(1)V L Fe2(SO4)3溶液中含Fe3+ a g,则该溶液中Fe3+的物质的量浓度为____molL﹣1,溶质的物质的量浓度为______ molL﹣1.
(2)12.4g Na2X含有0.4mol Na+,该物质的化学式__________.
(3)为了供学生课外活动,要求把SO42-、CO32-、H+、OH-、NH4+、Fe3+、Na+七种离子根据共存原理分为两组混合溶液,两组的离子数目要接近。分配结果是:
第一组:____________________;第二组:____________________。
【答案】 Cl MnCl2 1:5 KMnO4、Cl2、MnCl2、HCl(浓) 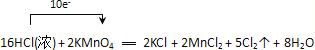 a/(56v) a/(112v) Na2O H+、SO42-、NH4+、Fe3+ OH-、CO32-、Na+
a/(56v) a/(112v) Na2O H+、SO42-、NH4+、Fe3+ OH-、CO32-、Na+
【解析】Ⅰ.(1)从元素化合价角度分析,盐酸氯元素化合价升高,被氧化;高锰酸钾中锰元素化合价降低,被还原生成MnCl2。
(2)每2mol KMnO4转移10mol电子,将10mol盐酸氧化为5mol氯气,所以,氧化剂与还原剂的物质的量之比是1:5。
(3)氧化剂的氧化性大于氧化产物的氧化性,即KMnO4>Cl2;还原剂的还原性大于还原产物的还原性,即HCl >MnCl2,氧化性MnCl2>HCl;总的氧化性强至弱为:KMnO4>Cl2 >MnCl2>HCl;
(4)电子转移方向和数目如图示: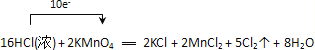
Ⅱ.(1)c(Fe3+)=n(Fe3+)/v=ag/56g/mol÷V L== a/(56v)mol/L;由Fe2(SO4)3=2 Fe3+ +3SO42—, 由计量数之比等于物质的量之比,c(Fe2(SO4)3)= )c(Fe3+)/2= a/(112v)mol/L;
(2)Na2X含有0.4mol Na+,则n(Na2X)= 0.4mol/2=0.2mol,M=m/n=12.4g/0.2mol=62g/mol,Mr=62,则X的相对原子质量为16即氧元素,Na2X的化学式为Na2O;
(3)H+与CO32-、OH-不能大量共存,OH-与H+、NH4+、Fe3+、不能大量共存,Fe3+与CO32-、OH-不能大量共存,因溶液中离子的电荷守恒,现离子数目要接近,将它们分为二组,一组为OH-、CO32-、Na+,另一组为H+、SO42-、NH4+、Fe3+。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下述实验能到达预期目的的是
选项 | 实验内容 | 实验目的 |
A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe (OH) 3胶体 |
D | 往混有FeCl2的CuCl2溶液中加人H2O2 后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
A. A B. B C. C D. D
【题目】某小组以醋酸为例探究弱酸的性质。
(1)实验一:探究酸的强弱对酸与镁条反应速率的影响。
①设计实验方案如下表,表中c =________ mol·L-1。
编号 | 酸的种类 | 酸的浓度/mol·L-1 | 酸的体积/mL | 镁条质量/g |
1 | 醋酸 | 1.0 | 10 | 2.0 |
2 | 盐酸 | c | 10 | 2.0 |
②实验步骤:a)检查装置(左图)的气密性后,添加药品;
b)反应开始后,___________________________(填写操作) ;
c)将所记录的数据转化为曲线图(右图)。
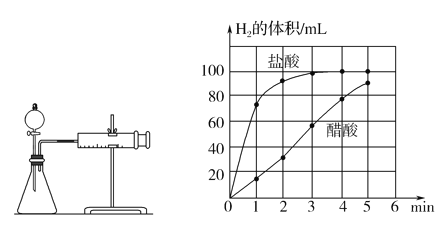
③写出0~5min醋酸、盐酸与镁条反应的反应速率变化规律:____________。
(2)实验二:现有一瓶醋酸溶液,常温下测定其中醋酸的电离程度(已电离的电解质分子数占原来总分子数的百分比)。
设计实验方案,将待测物理量和对应的测定方法填写在下表中。
待测物理量 | 测定方法 |
①__________ | 量取25.00mL醋酸溶液于锥形瓶中,滴加指示剂,将0.1000 mol·L-1 NaOH标准溶液装入______________中,滴定至终点,记录数据.重复滴定2次. |
②__________ | _______________________________________ |