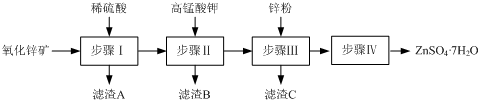
题目内容
14.实验室用如图所示装置制取并收集NO,请回答下列问题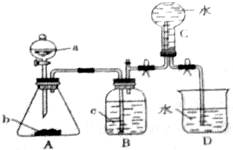
(1)仪器a的名称是分液漏斗.
(2)写出A中反应的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,其中HNO3表现的性质是酸性和强氧化性,当有4mol HNO3被还原时该反应中转移电子总数为12NA.
(3)装置B的作用是除去硝酸;
(4)A中产生的现象有金属溶解,得到蓝色溶液,生成无色气体,在锥形瓶上方变为红棕色.
分析 由图可知,分液漏斗中为稀硝酸,锥形瓶中为Cu,二者反应生成硝酸铜、NO和水,装置B除去挥发的硝酸,装置C排水法收集NO,D为尾气处理装置,以此来解答.
解答 解:(1)由图可知,仪器a的名称是分液漏斗,故答案为:分液漏斗;
(2)A中发生Cu与稀硝酸的反应,反应为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,生成硝酸铜体现硝酸的酸性,生成NO体现硝酸的强氧化性;有4mol HNO3被还原时该反应中转移电子总数为4mol×(5-2)×NA=12NA,故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;酸性和强氧化性;12NA;
(3)因硝酸易挥发,生成NO中混有硝酸,则装置B的作用是除去硝酸,故答案为:除去硝酸;
(4)A中发生3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O、2NO+O2=2NO2,观察到金属溶解,得到蓝色溶液,生成无色气体,在锥形瓶上方变为红棕色,
故答案为:金属溶解,得到蓝色溶液,生成无色气体,在锥形瓶上方变为红棕色.
点评 本题考查NO的制备实验,为高频考点,把握Cu与硝酸的反应及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
4.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物能量一定低于反应物总能量 | |
| B. | 放热反应不必加热就一定能发生 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H不同 |
2.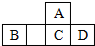 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
 四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素原子核外电子总数是其最外层电子数的3倍.下列有关判断正确的是( )| A. | 简单氢化物的热稳定性:C>A | |
| B. | 最高价氧化物对应水化物的酸性:D<C | |
| C. | B的最高价氧化物的水化物能与D的最高价氧化物的水化物反应 | |
| D. | 常温下它们的单质均为固态 |
9.10mL 3种气态烃的混合物和足量氧气混合点燃爆炸后恢复到原来状态(常温常压),气体体积共缩小了20mL(不考虑CO2的溶解).则这3种烃可能的组合是( )
| A. | CH4,C2H4,C3H6任意体积比 | |
| B. | CH4,C3H6,C2H2保持C3H6:C2H2=1:2(物质的量之比) | |
| C. | C2H6,C4H6,C2H2同条件下体积比为2:1:2 | |
| D. | C3H8,C4H8,C2H2质量比为11:14:26 |
19.为了测定“铁块”中铁元素的含量,实验流程如图所示:

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
(1)试剂A应选择C,试剂B应选择D(填序号)
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示:
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2 溶液 D氨水 E.MgCO3 固体
(2)若M的质量为11.2g,则该“铁块”中铁元素的含量是78.4%,若对所得过来吃固体直接洗涤、烘干、称量,计算“铁块”点的纯度,则结果偏小,原因可能是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
14. 滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.
(1)测定NaOH和Na2CO3的混合液中NaOH的含量.实验操作为:先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂).
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为溶液的颜色由红色变为浅红色,为何此种情况能测出NaOH的含量?能,酚酞的变色在碱性范围内,此时只有NaOH与HCl反应.
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?不能,滴定管的下端无刻度,若滴定液一直下降到活塞处,无法测出溶液的体积
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量.准确称取5.0000g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI═3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250mL,然后用5.0×10-4mol•L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+
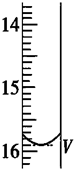
2S2O32-═2I-+S4O62-).取用Na2S2O3标准溶液应该用碱式式滴定管.有关实验数值如表(第一次滴定终点的数据如图所示,请将读得的数据填入表中).
该碘盐中碘元素的百分含量为0.03175%,下列操作中,会导致所测得的碘元素的百分含量偏大的是b.
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水.
 滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.(1)测定NaOH和Na2CO3的混合液中NaOH的含量.实验操作为:先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂).
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为溶液的颜色由红色变为浅红色,为何此种情况能测出NaOH的含量?能,酚酞的变色在碱性范围内,此时只有NaOH与HCl反应.
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?不能,滴定管的下端无刻度,若滴定液一直下降到活塞处,无法测出溶液的体积
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量.准确称取5.0000g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI═3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250mL,然后用5.0×10-4mol•L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+
2S2O32-═2I-+S4O62-).取用Na2S2O3标准溶液应该用碱式式滴定管.有关实验数值如表(第一次滴定终点的数据如图所示,请将读得的数据填入表中).
| 滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
| 第一次 | 25.00 | 0.00 | V=15.90 |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水.
15.下列表示的是N原子的轨道表示式: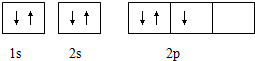 它违背了( )
它违背了( )
 它违背了( )
它违背了( )| A. | 能量守恒原理 | B. | 能量最低原理 | C. | 泡利不相容原理 | D. | 洪特规则 |