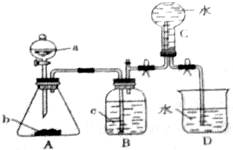
题目内容
14. 滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.
滴定分析是一种操作简便、准确度很高的定量分析方法,它可广泛应用于中和滴定、氧化还原反应等滴定中.某研究性学习小组的同学利用滴定分析法进行下面两项定量分析.(1)测定NaOH和Na2CO3的混合液中NaOH的含量.实验操作为:先向混合液中加过量的BaCl2溶液使Na2CO3完全转化成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂).
①向混有BaCO3沉淀的NaOH溶液中直接滴入盐酸,则终点颜色的变化为溶液的颜色由红色变为浅红色,为何此种情况能测出NaOH的含量?能,酚酞的变色在碱性范围内,此时只有NaOH与HCl反应.
②滴定时,若滴定管中的滴定液一直下降到活塞处才达到滴定终点,则能否由此准确地计算出结果?不能,滴定管的下端无刻度,若滴定液一直下降到活塞处,无法测出溶液的体积
(2)测定某品牌的碘盐(含有碘酸钾)中碘元素的百分含量.准确称取5.0000g该碘盐,溶于蒸馏水,然后与足量的KI溶液在酸性条件下混合(发生的反应为KIO3+3H2SO4+5KI═3K2SO4+3I2+3H2O),充分反应后将混合溶液稀释至250mL,然后用5.0×10-4mol•L-1的Na2S2O3标准溶液进行滴定(用淀粉作指示剂,反应为I2+
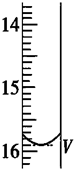
2S2O32-═2I-+S4O62-).取用Na2S2O3标准溶液应该用碱式式滴定管.有关实验数值如表(第一次滴定终点的数据如图所示,请将读得的数据填入表中).
| 滴定次数 | 待测液的体积(mL) | 滴定前的读数(mL) | 滴定后的读数(mL) |
| 第一次 | 25.00 | 0.00 | V=15.90 |
| 第二次 | 25.00 | 0.00 | 14.99 |
| 第三次 | 25.00 | 0.00 | 15.01 |
a.滴定终点时,俯视刻度
b.没有用Na2S2O3标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水.
分析 (1)①根据酚酞的变色范围是8~10,此时BaCO3不溶解,标准液的体积不变;
②根据滴定管的下端无刻度,若滴定液一直下降到活塞处,无法测出溶液的体积;
(2)碱性溶液用碱式滴定管盛放;滴定管读数为15.90;先求出三次的体积,根据数据的有效性,舍去第1组数据,然后求出2、3组平均消耗V(Na2S2O3),由浓度求出其物质的量,再根据方程式中的关系求出25mL待测溶液中KIO3的物质的量,然后求出KIO3的总物质的量和质量,其质量分数=$\frac{m(KI{O}_{3})}{m(样品)}$×100%;根据错误操作对消耗的标准溶液体积的影响分析误差.
解答 解:(1)①当达到终点时,溶液显弱碱性,酚酞由红色变为浅红色;酚酞的变色范围是8~10,此时BaCO3不溶解,标准液的体积不变,不影响NaOH含量的测定;
故答案为:溶液的颜色由红色变为浅红色;能,酚酞的变色在碱性范围内,此时只有NaOH与HCl反应;
②根据滴定管的下端无刻度,若滴定液一直下降到活塞处,无法测出溶液的体积,则不能测出NaOH含量;
故答案为:不能,滴定管的下端无刻度,若滴定液一直下降到活塞处,无法测出溶液的体积;
(2)碱性溶液用碱式滴定管盛放,Na2S2O3在溶液中水解显碱性,所以用碱式滴定管盛放;由图可知,滴定管读数为15.90;
三次消耗的Na2S2O3的体积分别为 15.90mL,14.99mL,15.01mL,第一次数据误差过大,应该舍去;
另外两次的平均值为 $\frac{14.99mL+15.01mL}{2}$=15.00mL,
则n(Na2S2O3)=cV=0.015L×5.0×10-4mol•L-1=7.5×10-6mol,
已知发生反应为:KIO3+3H2SO4+5KI═3K2SO4+3I2+3H2O,I2+2S2O32-═2I-+S4O62-,
则 KIO3~~~3I2~~~6S2O32-
1 6
n 7.5×10-6mol
所以n(KIO3)=1.25×10-6mol,
则KIO3的总物质的量为:1.25×10-6mol×$\frac{250mL}{25mL}$=1.25×10-5mol,n(I)=n(KIO3)=1.25×10-5mol,
m(I)=nM=1.25×10-5mol×127g/mol=1.5875×10-3g,
所以碘盐中碘元素的百分含量为$\frac{1.5875×1{0}^{-3}g}{5.0000g}$×100%=0.03175%;
a.滴定终点时,俯视刻度,则读数偏小,所以标准溶液的体积偏小,求出KIO3的物质的量的偏小,所以所测得的碘元素的百分含量偏小,故a不符合;
b.没有用Na2S2O3标准溶液润洗相应的滴定管,则Na2S2O3的浓度减小,滴定时消耗的Na2S2O3的体积偏大,求出KIO3的物质的量的偏大,所以所测得的碘元素的百分含量偏大,故b符合;
c.锥形瓶中有少量的蒸馏水对测定结果无影响,故c不符合;
故答案为:碱式;15.90;0.03175%;b.
点评 本题考查了物质含量的测定,主要考查了中和滴定实验操作、有关方程式的计算、误差分析等,题目难度中等,注意指示剂对测定结果的影响以及误差分析,侧重于考查学生的实验能力和计算能力.

| A. | 植物从土壤中吸收含氮养料 | |
| B. | 豆科植物把含氮化合物转变为蛋白质 | |
| C. | 将空气中的氮气转化为含氮化合物 | |
| D. | NH3经催化氧化生成NO |
 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.Ⅰ.实验前首先用浓度为0.1000mol/L酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)滴定过程中操作滴定管的图示正确的是A
(3)若配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”或“不变”)
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol/L.用该草酸按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性KMnO4溶液 | 实验目的 a.实验1和2探究___________ b.实验1和3探究反应物浓度对该反应速率的影响 c.实验1和4探究催化剂对该反应速率的影响 | |
| 体积 (mL) | 浓度 (mol/L) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(5)该小组同学对实验1和3分别进行的3次实验,测得以下实验数据(从混合振荡均匀开始计时)
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示):2MnO4-+10Cl-+16H+=5Cl2↑+2Mn 2++8H2O.
同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质.以其为原料制取硫酸铜的工艺
流程如下图所示:
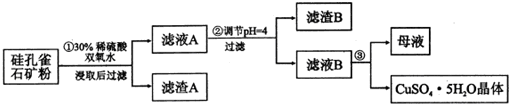
(1)步骤1中先加入足量稀硫酸,再加入双氧水,则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.Al2O3B.CuOC.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是:
取384gCuS在一定条件下和氧气完全反应,或发生:2CuS+3O2=2CuO+2SO2和
4CuS+5O2=2Cu2O+4SO2;两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为b mol,则a=a=$\frac{2}{5}$b-8.(氧气占空气体积的1/5)
| A. | pH减小 | B. | $\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$增大 | ||
| C. | 水的电离程度先减小后增大 | D. | Kb(NH3•H2O)不变 |
| A. | 漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AgNO3溶液中加入过量稀氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| D. | SO2使氯水褪色:SO2+Cl2+2H2O=SO42-+2Cl-+4H+ |