题目内容
6.磷酸亚铁锂(LiFePO4)是一种重要的锂离子电池电极材料,利用钛铁矿制备,钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有少量MgO、CaO、SiO2等杂质.工业上制取磷酸亚铁锂的流程如图所示: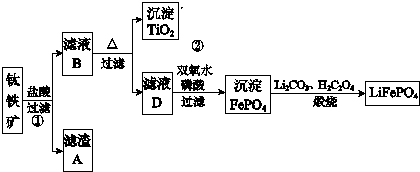
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-═Fe2++TiOCl42-+2H2O
请回答下列问题:
(1)写出①中杂质溶解的化学方程式MgO+2HCl=MgCl2+H2O,CaO+2HCl=CaCl2+H2O;
(2)纯净的滤渣A是制造光导纤维的基本原料;
(3)滤液B中TiOCl${\;}_{4}^{2-}$转化生成TiO2的离子方程式是TiOCl42-+H2O=TiO2↓+2H++4Cl-;
(4)②中反应的离子方程式是2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+;
(5)由滤液D制备LiFePO4的过程中,所需H2C2O4与34%双氧水的质量比是10:9;
(6)用磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:FePO4+Li$?_{充电}^{放电}$LiFePO4,该电池充电时阳极反应式是LiFePO4-e-=FePO4+Li+.
分析 铁矿石加入盐酸溶解过滤得到滤渣为二氧化硅,滤液B为MgCl2、CaCL2,FeCl2、TiOCl42-,加热促进水解,过滤得到沉淀TiO2,滤液D中加入过氧化氢氧化亚铁离子,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4;
(1)钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有少量MgO、CaO、SiO2等杂质,杂质中二氧化硅不溶于稀盐酸,成为滤渣A,FeTiO3(可表示为FeO•TiO2)和含有少量MgO、CaO溶于盐酸生成盐溶液,过滤得到滤液B为MgCl2、CaCL2,FeCl2、TiOCl42-;
(2)上述分析可知滤渣A为二氧化硅是光导纤维的基本材料;
(3)根据流程图示,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,结合电荷守恒和原子守恒写出离子方程式;
(4)滤液D中加入过氧化氢氧化亚铁离子,加入磷酸得到沉淀磷酸铁;
(5)根据电子守恒找出双氧水与草酸的关系式,然后列式计算计算出17%双氧水与H2C2O4的质量比;
(6)电池放电时原电池原理,Li失电子发生氧化反应做原电池负极,FePO4在正极得到电子发生还原反应生成LiFePO4.
解答 解:(1)钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2),含有少量MgO、CaO、SiO2等杂质,杂质中二氧化硅不溶于稀盐酸,成为滤渣A,FeTiO3(可表示为FeO•TiO2)和含有少量MgO、CaO溶于盐酸生成盐溶液,过滤得到滤液B为MgCl2、CaCL2,FeCl2、TiOCl42-,杂质溶解的化学方程式为:MgO+2HCl=MgCl2+H2O,CaO+2HCl=CaCl2+H2O,
故答案为:MgO+2HCl=MgCl2+H2O,CaO+2HCl=CaCl2+H2O;
(2)由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,是光导纤维的基本材料,
故答案为:光导纤维;
(3)根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O=TiO2↓+2H++4Cl-,
故答案为:TiOCl42-+H2O=TiO2↓+2H++4Cl-;
(4)滤液D中加入过氧化氢氧化亚铁离子,加入磷酸得到沉淀磷酸铁,结合原子守恒和电荷守恒写出反应的离子方程式为:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+,
故答案为:2Fe2++H2O2+2H3PO4=2FePO4↓+2H2O+4H+;
(5)根据电子守恒,氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,
因此可得关系式:H2O2~H2C2O4,设双氧水质量为x,草酸质量为y,
34 90
x×34% y
34y=90×x×34%,x:y=10:9,
34%双氧水与H2C2O4的质量比为10:9,
故答案为:10:9;
(6)用磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:FePO4+Li$?_{充电}^{放电}$LiFePO4,充电过程为电解池反应,该电池充电时阳极是LiFePO4,失电子发生氧化反应,电极反应式是:LiFePO4-e-=FePO4+Li+,
故答案为:LiFePO4-e-=FePO4+Li+.
点评 本题考查物质制备、分离提纯,原电池、电解池原理的分析判断,主要是过程分析判断,化学方程式和离子方程式的书写应用,掌握物质性质是解题关键,题目难度中等.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
 酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.
酸性KMnO4溶液能与草酸(H2C2O4)溶液反应,某探究小组利用反应过程中溶液紫色消失的快慢来研究影响反应速率的因素.Ⅰ.实验前首先用浓度为0.1000mol/L酸性KMnO4标准溶液滴定未知浓度的草酸.
(1)写出滴定过程中发生反应的离子方程式2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)滴定过程中操作滴定管的图示正确的是A
(3)若配置酸性KMnO4标准溶液时,俯视容量瓶的刻度线,会使测得的草酸溶液浓度偏低(填“偏高”、“偏低”或“不变”)
Ⅱ.通过滴定实验得到草酸溶液的浓度为0.2000mol/L.用该草酸按下表进行后续实验(每次实验草酸溶液的用量均为8mL).
| 实验 编号 | 温度 (℃) | 催化剂 用量(g) | 酸性KMnO4溶液 | 实验目的 a.实验1和2探究___________ b.实验1和3探究反应物浓度对该反应速率的影响 c.实验1和4探究催化剂对该反应速率的影响 | |
| 体积 (mL) | 浓度 (mol/L) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
(5)该小组同学对实验1和3分别进行的3次实验,测得以下实验数据(从混合振荡均匀开始计时)
| 实验 编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
(6)该实验中使用的催化剂应选择MnSO4并非MnCl2,原因为(离子方程式表示):2MnO4-+10Cl-+16H+=5Cl2↑+2Mn 2++8H2O.
同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质.以其为原料制取硫酸铜的工艺
流程如下图所示:
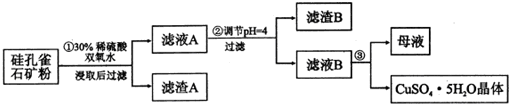
(1)步骤1中先加入足量稀硫酸,再加入双氧水,则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.Al2O3B.CuOC.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是:
取384gCuS在一定条件下和氧气完全反应,或发生:2CuS+3O2=2CuO+2SO2和
4CuS+5O2=2Cu2O+4SO2;两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为b mol,则a=a=$\frac{2}{5}$b-8.(氧气占空气体积的1/5)
| A. | pH减小 | B. | $\frac{c(N{H}_{4}^{+})}{c(O{H}^{-})}$增大 | ||
| C. | 水的电离程度先减小后增大 | D. | Kb(NH3•H2O)不变 |
 甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
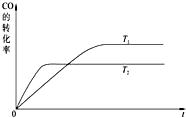
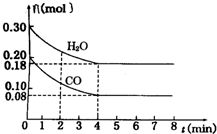 在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)
在一体积为2L的容器中,通入一定量的CO和H2O,850℃时发生反应:CO(g)+H2O(g)═CO2(g)+H2(g)