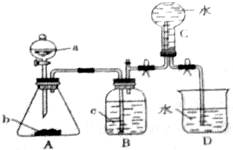
题目内容
9.10mL 3种气态烃的混合物和足量氧气混合点燃爆炸后恢复到原来状态(常温常压),气体体积共缩小了20mL(不考虑CO2的溶解).则这3种烃可能的组合是( )| A. | CH4,C2H4,C3H6任意体积比 | |
| B. | CH4,C3H6,C2H2保持C3H6:C2H2=1:2(物质的量之比) | |
| C. | C2H6,C4H6,C2H2同条件下体积比为2:1:2 | |
| D. | C3H8,C4H8,C2H2质量比为11:14:26 |
分析 设烃的混合物的平均化学式为CxHy,在氧气中燃烧的化学方程式为:CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{4}$H2O(l),根据体积变化,则1:(1+$\frac{y}{4}$)=10mL:20ml,解得:y=4,即混合气体分子中平均含有4个H原子,结合选项计算判断.
解答 解:设烃的混合物的平均化学式为CxHy,则:
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2+$\frac{y}{4}$H2O(l) 体积减小
1 1+$\frac{y}{4}$
10mL 20mL
则1:(1+$\frac{y}{4}$)=10mL:20mL,解得:y=4,即混合气体分子中平均含有4个H原子,
A.CH4、C2H4分子均含有4个H原子,而C3H6含有6个H原子,其混合物中氢原子的平均数不可能为4,故A错误;
B.CH4、C3H6、C2H2混合,应保持C3H6:C2H2=1:1(物质的量之比)才能满足混合物中H原子数平均为4,故B错误;
C.C2H6、C4H6、C2H2同条件下体积比为2:1:1,平均H原子数目为:$\frac{2×6+6+2}{2+1+1}$=5,故C错误;
D.C3H8、C4H8、C2H2质量比为11:14:26,则其物质的量之比为:$\frac{11}{44}$:$\frac{14}{56}$:$\frac{26}{26}$=1:1:4,平均H原子数目为:$\frac{8+8+2×4}{1+1+4}$=4,故D正确;
故选D.
点评 本题考查混合物的计算,题目难度中等,注意掌握差量法与平均分子式在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.

 金钥匙试卷系列答案
金钥匙试卷系列答案①K通常保存在煤油中,以隔绝与空气的接触
②从Li到Cs,碱金属与水反应越来越不剧烈
③钠的焰色反应呈黄色,焰色反应是化学变化
④碱金属阳离子,氧化性最强的是Li+
⑤碱金属的原子半径和离子半径都随核电荷数的增大而增大
⑥从Li到Cs,碱金属的密度越来越大,熔、沸点越来越高
⑦CsOH是强碱,碱性比KOH强
⑧Cs2CO3加热时易分解成CO2和Cs2O.
| A. | ②③⑥⑧ | B. | ②③④⑦ | C. | ④⑤⑥⑧ | D. | ①④⑤⑦ |
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
①CO2、CO的物质的量浓度之比为1:2的状态
②混合气体的密度不再改变的状态
③混合气体的压强不再改变的状态
④单位时间内生成nmolCO2的同时生成nmolC
⑤单位时间内生成nmolCO2 的同时生成2nmolCO
⑥C的质量不再改变的状态.
| A. | ①④⑤⑥ | B. | ②③⑤⑥ | C. | ②④⑤⑥ | D. | ①②③④ |
同时含有SiO2、FeCO3、Fe2O3、A12O3等杂质.以其为原料制取硫酸铜的工艺
流程如下图所示:
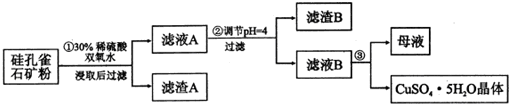
(1)步骤1中先加入足量稀硫酸,再加入双氧水,则双氧水参与该反应的离子方程式是2Fe2++H2O2+2H+═2Fe3++2H2O
(2)步骤②调节溶液pH,可以选用的试剂是BC.(填字母编号)
A.Al2O3B.CuOC.CuCO3•Cu(OH)2
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(4)将滤液B通过蒸发浓缩、冷却结晶、过滤等操作可得到硫酸铜晶体.
(5)硫酸铜也可用硫化铜和氧气在高温、催化剂条件下化合制得,该反应的化学方程式是:
取384gCuS在一定条件下和氧气完全反应,或发生:2CuS+3O2=2CuO+2SO2和
4CuS+5O2=2Cu2O+4SO2;两个反应,在所得固体中Cu和O的物质的量之比n(Cu):n(O)=4:a,此时消耗空气的物质的量为b mol,则a=a=$\frac{2}{5}$b-8.(氧气占空气体积的1/5)
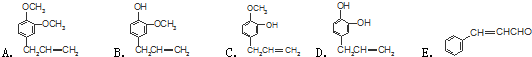
 $\stackrel{反应②}{→}$X,
$\stackrel{反应②}{→}$X,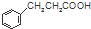 .
.