题目内容
【题目】已知 。室温下用
。室温下用![]() 的
的![]() 滴定
滴定![]() 某一元酸
某一元酸![]() 的结果如图所示,下列说法中正确的是
的结果如图所示,下列说法中正确的是

A. ![]() 属于弱酸
属于弱酸
B. 整个过程中,![]() 点时水的电离程度最大
点时水的电离程度最大
C. ![]() 点对应液中
点对应液中![]()
D. ![]() 的数量级为
的数量级为![]()
【答案】D
【解析】
A. 由A点可知0.01mol/LHQ溶液中c(H+)=0.01mol/L,所以![]() 属于强酸,故A错误;
属于强酸,故A错误;
B. 整个过程中,当酸碱恰好完全反应生成盐时,水的电离程度最大,由于生成的盐是强酸弱碱盐,此时溶液显酸性,而C点为中性,故B错误;
C.E点溶液为等浓度NH4Q和NH3·H2O混合液,根据电荷守恒有:c(OH-)+c(Q-)=c(NH4+)+c(H+) ,根据物料守恒有:2c(Q-)=c(NH4+)+c(NH3·H2O),所以![]() 点对应液中2c(OH-)+c(NH3·H2O)=c(NH4+)+2c(H+),故C错误;
点对应液中2c(OH-)+c(NH3·H2O)=c(NH4+)+2c(H+),故C错误;
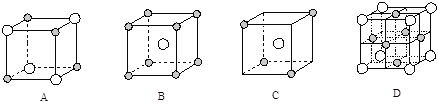
D. E点溶液为等浓度NH4Q和NH3·H2O混合液,由于电离和水解都很微弱,c(NH3·H2O![]() c(NH4+)。NH3·H2O
c(NH4+)。NH3·H2O![]() NH4++ OH-,Kb(NH3·H2O)=
NH4++ OH-,Kb(NH3·H2O)=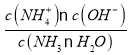 ≈c(OH-),由图象可知,E点时
≈c(OH-),由图象可知,E点时 =-4.5,再根据水的离子积Kw= c(H+)×c(OH-)=1
=-4.5,再根据水的离子积Kw= c(H+)×c(OH-)=1![]() 10-14,解得c(OH-)=10-4.75=100.25
10-14,解得c(OH-)=10-4.75=100.25![]() 10-5,所以
10-5,所以![]() 的数量级为
的数量级为![]() ,故D正确。
,故D正确。
故选D。

【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:

已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol L -1形成M(OH) n沉淀的pH范围如下:

③常温下,Ksp(CaF2) ═1.46×10-10 Ksp(MgF2) ═7.42×10-11 Ka(HF) ═1.00 ×10-4
回答下列问题:
(1)分析下列图1、图2,氯化铵焙烧锰矿粉的最佳条件是:__________________。

(2)“焙烧”时发生的主要反应的化学方程式为_________________________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为__________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去;然后加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液pH为6,c(Mg2+)═4.64×10-6 mol·L-1,c(HF)为_________mol·L-1。
(4)碳化结晶时,反应的离子方程式为_____________________________________。
(5)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(6)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__________,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度___(填“偏高”“ 偏低”或“无影响”)。