题目内容
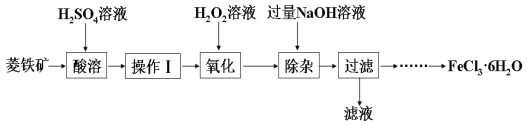
【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:

已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+) ═ 0.1 mol L -1形成M(OH) n沉淀的pH范围如下:

③常温下,Ksp(CaF2) ═1.46×10-10 Ksp(MgF2) ═7.42×10-11 Ka(HF) ═1.00 ×10-4
回答下列问题:
(1)分析下列图1、图2,氯化铵焙烧锰矿粉的最佳条件是:__________________。

(2)“焙烧”时发生的主要反应的化学方程式为_________________________。
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为__________;再调节溶液的pH将Al3+、Fe3+变为沉淀除去;然后加入NH4F将Ca2+、Mg2+沉淀除去,此时溶液pH为6,c(Mg2+)═4.64×10-6 mol·L-1,c(HF)为_________mol·L-1。
(4)碳化结晶时,反应的离子方程式为_____________________________________。
(5)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(6)测定碳酸锰产品的纯度。
称取0.5000 g碳酸锰产品于锥形瓶中,加25.00 mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100 mL,滴加2~3滴指示剂,然后用浓度为0.2000 mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+ ═Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000 mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__________,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度___(填“偏高”“ 偏低”或“无影响”)。
【答案】500℃ m(NH4Cl):m(锰矿粉)=1.10 MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O 4.0×10-5 Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O 4.0×10-5 Mn2++2HCO3-![]() MnCO3+CO2↑+H2O 碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀 92.00% 偏低
MnCO3+CO2↑+H2O 碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀 92.00% 偏低
【解析】
将菱锰矿粉(主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素)和氯化铵混合研磨后焙烧,反应生成二氧化碳和氨气,因此反应方程式为MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O,浸出,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,浸出液需要净化除杂,根据(3)的提示,需要加入MnO2将Fe2+氧化为Fe3+,再调节溶液的pH将Al3+、Fe3+变为Al(OH)3、Fe(OH)3沉淀除去,然后加入NH4F将Ca2+、Mg2+以CaF2、MgF2沉淀除去,净化液中主要溶质为MnCl2、NH4Cl,加入碳酸氢铵发生反应:Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O,浸出,浸出液含有Mn2+、Fe2+、Al3+、Ca2+、Mg2+,浸出液需要净化除杂,根据(3)的提示,需要加入MnO2将Fe2+氧化为Fe3+,再调节溶液的pH将Al3+、Fe3+变为Al(OH)3、Fe(OH)3沉淀除去,然后加入NH4F将Ca2+、Mg2+以CaF2、MgF2沉淀除去,净化液中主要溶质为MnCl2、NH4Cl,加入碳酸氢铵发生反应:Mn2++2HCO3- ![]() MnCO3↓+CO2↑+H2O,炭化结晶,过滤,滤饼干燥后得到MnCO3,滤液为NH4Cl溶液,蒸发结晶得到NH4Cl固体,可循环使用,据此分析解答。
MnCO3↓+CO2↑+H2O,炭化结晶,过滤,滤饼干燥后得到MnCO3,滤液为NH4Cl溶液,蒸发结晶得到NH4Cl固体,可循环使用,据此分析解答。
(1)根据图像可知,锰的浸出率随着温度的升高而增大,随着m(NH4Cl)∶m(锰矿粉)增大而增大,500℃、m(NH4Cl)∶m(锰矿粉)=1.10时,锰的浸出率最高,温度过高,m(NH4Cl)∶m(锰矿粉)再打,浸出率变化不大,成本增加,故焙烧温度取500℃、m(NH4Cl)∶m(锰矿粉)=1.10即可;故答案为:500℃、m(NH4Cl)∶m(锰矿粉)=1.10;
(2)将菱锰矿粉(主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素)和氯化铵混合研磨后焙烧,反应生成二氧化碳和氨气,因此反应方程式为MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O,故答案为:MnCO3+2NH4Cl
MnCl2+2NH3↑+CO2↑+H2O,故答案为:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O;
MnCl2+2NH3↑+CO2↑+H2O;
(3)MnO2将Fe2+氧化为Fe3+,离子反应为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;已知:常温下,Ksp(MgF2)═7.42×10-11,Ka(HF)═1.00×10-4,溶液pH为6,c(Mg2+)═4.64×10-6molL-1,则此时c(F-)=![]() mol/L=4×10-3mol/L,Ka(HF)═
mol/L=4×10-3mol/L,Ka(HF)═![]() =1.00×10-4,c(HF)=
=1.00×10-4,c(HF)=![]() =4.0×10-5mol/L,故答案为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;4.0×10-5;
=4.0×10-5mol/L,故答案为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;4.0×10-5;
(4)碳化结晶时,反应的方程式为:Mn2++2HCO3- ![]() MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3-
MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3- ![]() MnCO3↓+CO2↑+H2O;
MnCO3↓+CO2↑+H2O;
(5)碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀,故碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液,故答案为:碳酸根离子水解程度大,碳酸铵溶液中c(OH-)较大,易产生Mn(OH)2沉淀;
(6)根据表格数据,三次消耗硫酸亚铁铵标准溶液的体积(mL)分别为:20.10、20.00、19.90,消耗的平均体积为20.00 mL,根据关系式:MnCO3~Mn(PO4)2]3-~(NH4)2Fe(SO4)2,则n(MnCO3)=n(硫酸亚铁铵)=0.2000mol/L×0.02L=0.004mol,产品的纯度为![]() ×100%=92.00%;若滴定终点时发现滴定管尖嘴处产生了气泡,则标准液消耗的体积读数偏小,故测得的碳酸锰粗产品的纯度偏低,故答案为:92.00%;偏低。
×100%=92.00%;若滴定终点时发现滴定管尖嘴处产生了气泡,则标准液消耗的体积读数偏小,故测得的碳酸锰粗产品的纯度偏低,故答案为:92.00%;偏低。

【题目】现用0.1000 mol·L1KMnO4酸性溶液滴定未知浓度的无色H2C2O4溶液,反应离子方程式是:2MnO4+5H2C2O4+6H+![]() 2Mn2++10CO2↑+8H2O。填空完成问题:
2Mn2++10CO2↑+8H2O。填空完成问题:
(1)该滴定实验必需的玻璃仪器有______________。(填字母)
A.酸式滴定管 B.碱式滴定管 C.量筒 D.锥形瓶
E.铁架台 F.滴定管夹 G.白纸 H.漏斗
(2)不用________(填“酸”或“碱”)式滴定管盛放高锰酸钾溶液。试分析原因___________________。
(3)滴定终点的现象为_________________________________________________________。
(4)若滴定开始和结束时,滴定管中的液面如图所示,则起始读数为____mL,终点读数为_____mL。

(5)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测H2C2O4溶液的体积/mL | 0.1000 mol/L KMnO4的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该H2C2O4溶液的物质的量浓度为_______________。
(6)下列操作中可能使测定结果偏低的是___________(填字母)。
A.酸式滴定管未用标准液润洗就直接注入KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取KMnO4标准液时,开始仰视读数,滴定结束时俯视读数