题目内容
【题目】已知HA为一元酸,常温下向20mL0.01mol/L的HA溶液中滴加0.01mol/L的NaOH溶液,测得溶液pH与所加NaOH溶液体积关系如图所示。下列说法不正确的是

A. 常温下,该酸的电离常数K=10-5.6
B. 该测定过程中不可以选择甲基橙为指示剂
C. 滴定至①处时,溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-)
D. 由①到③过程中,水的电离程度先增大后减小
【答案】D
【解析】根据0.01mol/L的HA溶液pH大于2可以知道HR为弱酸,该过程为一元强碱滴定一元弱酸的过程,①点溶液为等浓度的HA和NaA的混合溶液,且溶液显酸性;②点溶液中呈中性;③点溶液是二者恰好完全反应生成NaA,强碱弱酸盐,溶液显碱性;酸碱溶液对水的电离起到抑制作用,水解的盐对水的电离起到促进作用,以此分析解答。
详解:A. HA![]() H++A-,pH=3.8,c(H+)=10-3.8,该酸的电离常数K=
H++A-,pH=3.8,c(H+)=10-3.8,该酸的电离常数K=![]() =
=![]() =10-5.6,故A正确;
=10-5.6,故A正确;
B.该测定为强碱滴弱酸,反应完全时,生成强碱弱酸盐,溶液显碱性,应该选择酚酞为指示剂,若选用甲基橙为指示剂,因甲基橙变色范围3.1![]() 4.4,误差较大,故B正确;
4.4,误差较大,故B正确;
C. ①点溶液为等浓度的HA和NaA的混合溶液,且溶液显酸性;HA的电离大于A-水解,则溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-),故C正确;
D. 在①、②、③点对应的溶液中, ①点溶液为等浓度的HA和NaA的混合溶液,且溶液显酸性;②点溶液中呈中性;③点溶液是二者恰好完全反应生成NaA,强碱弱酸盐,溶液显碱性;酸碱溶液对水的电离起到抑制作用,水解的盐对水的电离起到促进作用,所以由①到③过程中,水的电离程度逐渐增大,故D错误;
综上所述,本题正确答案为D。

【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。

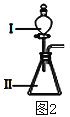
试回答:
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D离子所含电子数和质子数均相同的微粒是________________。(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的_________________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ___________,Ⅱ__________,观察到的实验现象是________________________。
(4)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有___________________________________;
②b与c反应的化学方程式为_________________________________。




