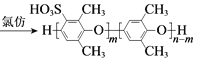
��Ŀ����
����Ŀ����֪Ԫ��A��B��C��D��E��ԭ��������������A��B��C��D����Ԫ�غ˵������С��20��A��Bͬ���壻B��C��DԪ�صĻ�̬ԭ�Ӿ�����ͬ���ܲ��������ǵĻ�̬ԭ����p�ܼ���δ�ɶԵ������ֱ�Ϊ1��3��1��E�����ڱ��У���������Ԫ���⣩��һ��������С��Ԫ�ء��ش��������⣺
��1��д������Ԫ�صķ��ţ�A ��E ��
��2��CԪ�صļ۵����Ų�ͼΪ�� ��
���Ų���ѭ��ԭ����Ҫ�У� ���������÷֣���
��3��C��DԪ���γɵĻ�������Ҫ�У� ���ѧʽ���������÷֣���������Է���������С�ķ���Ϊ ���ӣ����������������Ǽ����������÷��ӵĿռ乹��Ϊ ������ԭ�ӵ��ӻ���ʽ�� ��
��4��������BD3���۵�190�����е�182.7������ôBD3�ľ�������Ϊ ����ʵ�ϣ���BD3�Ļ�������������B2D6����ʽ���ڣ�����ʽ�Ĵ��������� �γɵġ���ѡ����������������»������������Ӽ���������λ������
��5����ͼΪ���־���������1/8��ʾ��ͼ������![]() ��
��![]() �������ֲ�ͬ�����ӡ�E��D�γɵĻ�����ľ����������е� ������ţ����ڸþ����������ӵ���λ��Ϊ ��
�������ֲ�ͬ�����ӡ�E��D�γɵĻ�����ľ����������е� ������ţ����ڸþ����������ӵ���λ��Ϊ ��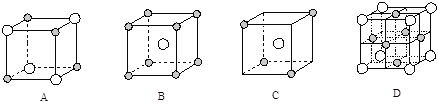
���𰸡���1��B Cs ��2��![]() ����ԭ��������ԭ�������ع���
����ԭ��������ԭ�������ع���
��3��PCl3��PCl5���� ������ sp3
��4�����Ӿ��� ��λ�� ��5��B 8
��������
���⣨1��B��C��DԪ�صĻ�̬ԭ�Ӿ�����ͬ���ܲ��������ǵĻ�̬ԭ����p�ܼ���δ�ɶԵ������ֱ�Ϊ1��3��1����ԭ���������ε�������С��20������B�������Ԫ�أ�����A��B��ͬ����ģ���A��ԭ��������С������B��Al��A��B����C��P��D��Cl��E�����ڱ��У���������Ԫ���⣩��һ��������С��Ԫ�أ����ڽ�����Խǿ����һ������ԽС������E��Cs��
��2�����ݹ���ԭ����֪��PԪ�صļ۵����Ų�ͼΪ![]() �����Ų�ͼ������ѭ����ԭ���⣬����ѭ������ԭ�������ع���
�����Ų�ͼ������ѭ����ԭ���⣬����ѭ������ԭ�������ع���
��3��P��Cl�γɵĻ�������PCl3��PCl5��������Է���������С��PCl3������Pԭ�Ӻ���1�Թ¶Ե��ӣ������������νṹ�����ڼ��Է��ӣ�������ԭ��Pԭ����sp3�ӻ���
��4�������Ȼ������۷е�ϵͿ�֪���û������γɵľ���Ӧ���Ƿ��Ӿ��塣������Ԫ�غ��й¶Ե��ӣ�����Ԫ�غ��пչ�������Ի������γ���λ����
��5���Ȼ���γɵľ��������Ӿ��壬��������λ����8�����Դ�ѡB��

 ��У����ϵ�д�
��У����ϵ�д�