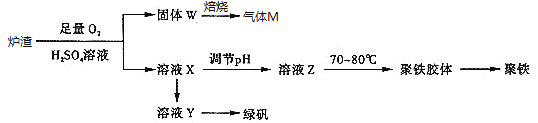
题目内容
【题目】在2 L的密闭容器内,500℃时反应2SO2(g)+O2(g) ![]() 2SO3(g)ΔH<0体系中,n(SO2)随时间的变化如表:
2SO3(g)ΔH<0体系中,n(SO2)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=______________________。
(2)下图表示SO3的变化的曲线是__________。用O2表示从0~2s内该反应的平均速率v=______________。

(3)能说明该反应已达到平衡状态的是________。
a.v(SO3)=2v(O2) b.容器内压强保持不变
c.v逆(SO2)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出SO3气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂
(5)若在容积均为2 L的密闭容器内,500℃时按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g)ΔH=-QkJ·mol-1(Q>0),保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
2SO3(g)ΔH=-QkJ·mol-1(Q>0),保持恒温恒容。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molSO2、 1molO2 | 2molSO3 | 4molSO2、 2molO2 |
平衡时n(SO3) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | p1 | p2 | p3 |
反应物的转化率 | α1 | α2 | α3 |
三个容器中的反应分别达平衡时下列各组数据关系正确的是____(填字母)。
A.α1+α2=1 B. Q1+Q2=Q C. α3<α1 D. p3<2p1=2p2 E. n2<n3<1.0mol F. Q3=2Q1
(6)在一定条件下进行反应2SO2(g)+O2(g) ![]() 2SO3(g),如图所示。
2SO3(g),如图所示。
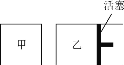
相同温度下,在甲、乙两容器中各投入2molSO2、1molO2,甲、乙两容器的初始体积均为1L,甲、乙容器达到平衡所用时间:甲____(填“>”、“<”或“=”,下同)乙,平衡时SO2的转化率:甲____乙。
【答案】![]() b 1.5×10-3 mol·L-1·s-1 bc c ABD > <
b 1.5×10-3 mol·L-1·s-1 bc c ABD > <
【解析】
(1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积,所以该反应的平衡常数表达式K=![]() ,故答案为:
,故答案为:![]() 。
。
(2)三氧化硫是生成物,平衡时生成三氧化硫的物质的量是0.013mol,其浓度为0.013mol÷2L=0.0065mol/L,所以根据图像可知,表示SO3变化曲线的是b。0s~2s内消耗SO2的物质的量是0.020mol-0.008mol=0.012mol,则根据方程式可知消耗氧气的物质的量是0.006mol,其浓度为0.003mol/L,则用O2表示从0s~2s内该反应的平均速率:v=0.003mol/L÷2s=0.0015mol·L-1·s-1,故答案为:b,1.5×10-3mol·L-1·s-1。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,则
a.v(SO3)=2v(O2)符合反应速率之比是相应的化学计量数之比,但不能确定反应速率的方向,不能说明达到平衡状态,故a错误;
b.容器内压强保持不变能说明达到平衡状态,故b正确;
c.v逆(SO2)=2v正(O2)符合反应速率之比是相应的化学计量数之比,且反应速率的方向相反,能说明达到平衡状态,故c正确;
d.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此容器内密度保持不变不能说明反应达到平衡状态,故d错误。
故答案为:bc。
(4)a.及时分离出SO3气体,瞬间逆反应速率减小,正反应速率不变,平衡向正反应进行,随后反应混合物各组分的浓度降低,速率减小,故a错误;
b.适当升高温度反应速率增大,平衡向吸热反应移动,即平衡向逆反应移动,故b错误;
c.增大O2的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应进行,随后生成物的浓度增大,逆反应速速率增大,故c正确;
d.加入高效催化剂,同等程度增大正、逆反应速率,平衡不移动,故d错误。
故答案为:c。
(5)A.甲、乙为等效平衡,平衡时O2的物质的量相等,令平衡时O2为amol,甲中O2转化率α1=![]() =1-a,平衡时SO3的物质的量=(1-a)mol,乙中参加反应的SO3为amol,乙中的转化率α2=a,故α1+α2=1,故A正确;
=1-a,平衡时SO3的物质的量=(1-a)mol,乙中参加反应的SO3为amol,乙中的转化率α2=a,故α1+α2=1,故A正确;
B.甲、乙为等效平衡,平衡时O2的物质的量相等,令平衡时O2为bmol,则甲中参加反应的O2为(1-b)mol,放出的热量Q1=Q(1-b),乙中参加反应的SO3为bmol,吸收的热量Q2=bQ,故Q1+Q2=Q(1-b)+bQ=Q,故B正确;
C.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应方向移动,转化率增大,即α3>α1,故C错误;
D.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强等效,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故压强P3<2P1=2P2,故D正确;
E.由D中分析可知,n2=0.5,n3>1.0mol,故E错误;
F.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,丙中参加反应的O2的物质的量大于甲中的2倍,则Q3>2Q1,故F错误。
故答案为:ABD。
(6)根据图像可知,甲是保持温度和容积不变的,乙是保持温度和压强不变的,因此,在反应过程中,乙中的压强始终大于甲中的压强,所以甲中的反应速率小,达到平衡的时间长,但由于正反应是体积减小的反应,所以压强越大,反应物的转化率越高,故答案为:>,<。