��Ŀ����
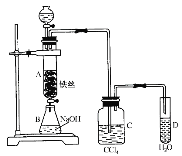
����Ŀ��ij��ȤС����������װ�ã�������������ص�ʵ�顣
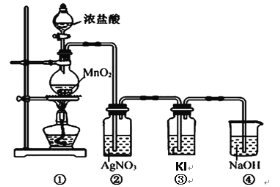
��ش�
(1)д��ʵ����������������ȡ�����Ļ�ѧ����ʽ_________��
(2)���ø�ԭ����װ�âٽ���ʵ�飬�Ƶõ��������������е����ʿ�����ͨ�뵽_________��_________��ȥ��
(3)װ�â��г��ְ�ɫ�������ݴ������ܷ��Ʋ�װ�â�������Cl2_________(������������������)����˵������_________��
(4)ʵ���ҴӺ�������ȡ��ľ�������װ�â۵�ԭ������д������Һ�з�����Ӧ�����ӷ�Ӧ����ʽ_________��
(5)ͼ�Т���ʾ����Һ��Ϊ�˼��ٶԻ�������Ⱦ����д������Һ�з�����Ӧ�����ӷ�Ӧ����ʽ_________��
���𰸡�MnO2+4HCl(Ũ)![]() MnCl2 +Cl2��+2H2O ����ʳ��ˮ Ũ���� �� Ũ����ӷ��������Ȼ���Ҳ�����������Ӧ��Ҳ�������ɫ���� Cl2+2I-=I2+2Cl- Cl2+2OH-=Cl-+ClO-+H2O
MnCl2 +Cl2��+2H2O ����ʳ��ˮ Ũ���� �� Ũ����ӷ��������Ȼ���Ҳ�����������Ӧ��Ҳ�������ɫ���� Cl2+2I-=I2+2Cl- Cl2+2OH-=Cl-+ClO-+H2O
��������
��ʵ����������MnO2��Ũ�����ڼ��������·�����Ӧ��ȡ������Ũ������лӷ��ԣ��������ȡ�õ���Cl2�л�������HCl��ˮ��������ͨ������NaCl��Һ��ȥHCl����ͨ��Ũ������Ȼ���ٽ���Cl2��KI��Һ�ķ�Ӧ��������ȡ�õ�������ֱ��ͨ��AgNO3��Һ�У�������HCl��Ӧ������Ҳ������Cl2��ˮ��Ӧ�õ���HCl��Ӧ������Cl2�ж������ŷ�ǰҪ��NaOH��Һ����β�����������ŷš�
(1)ʵ������MnO2��Ũ�����ڼ��������·�����Ӧ��ȡ��������Ӧ����ʽΪ��MnO2+4HCl(Ũ)![]() MnCl2 +Cl2��+2H2O��
MnCl2 +Cl2��+2H2O��
(2)���ø�ԭ����װ�âٽ���ʵ�飬�Ƶõ������к��е�������HCl��ˮ������Ҫ��ͨ�뵽����ʳ��ˮ�г�ȥCl2����ͨ��Ũ�����ȥˮ������
(3)����Ũ������лӷ��ԣ��ӷ��������Ȼ���Ҳ�����������Ӧ��������ɫ����������װ�â��г��ְ�ɫ�������ݴ��������Ʋ�װ�â�������Cl2��
(4)ʵ���ҴӺ�������ȡ��ľ�������װ�â۵�ԭ����Cl2��KI������Ӧ����KCl��I2����Ӧ�����ӷ�Ӧ����ʽΪ��Cl2+2I-=I2+2Cl-��
(5)ͼ�Т���ʾ����Һ��Ϊ�˼��ٶԻ�������Ⱦ���ڸ���Һ��Cl2��NaOH��Һ��Ӧ����NaCl��NaClO��H2O��������Ӧ�����ӷ�Ӧ����ʽΪCl2+2OH-=Cl-+ClO-+H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����2 L���ܱ������ڣ�500��ʱ��Ӧ2SO2(g)��O2(g) ![]() 2SO3(g)��H<0��ϵ�У�n(SO2)��ʱ��ı仯�����
2SO3(g)��H<0��ϵ�У�n(SO2)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)д���÷�Ӧ��ƽ�ⳣ������ʽ��K��______________________��
(2)��ͼ��ʾSO3�ı仯��������__________����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ������v��______________��

(3)��˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��v(SO3)��2v(O2) b��������ѹǿ���ֲ���
c��v��(SO2)��2v��(O2) d���������ܶȱ��ֲ���
(4)Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����________��
a����ʱ�����SO3���� b���ʵ������¶� c������O2��Ũ�� d��ѡ���Ч����
(5)�����ݻ���Ϊ2 L���ܱ������ڣ�500��ʱ����ͬ��ʽͶ�뷴Ӧ�������Ӧ2SO2(g)��O2(g)![]() 2SO3(g)��H=-QkJ��mol-1(Q>0)�����ֺ��º��ݡ���ʼͶ����������ﵽƽ��ʱ���й���������:
2SO3(g)��H=-QkJ��mol-1(Q>0)�����ֺ��º��ݡ���ʼͶ����������ﵽƽ��ʱ���й���������:
ʵ�� | �� | �� | �� |
��ʼͶ�� | 2molSO2�� 1molO2 | 2molSO3 | 4molSO2�� 2molO2 |
ƽ��ʱn(SO3) | 0.5mol | n2 | n3 |
��Ӧ�������仯 | �ų�Q1kJ | ����Q2kJ | �ų�Q3kJ |
��ϵ��ѹǿ | p1 | p2 | p3 |
��Ӧ���ת���� | ��1 | ��2 | ��3 |
���������еķ�Ӧ�ֱ��ƽ��ʱ���и������ݹ�ϵ��ȷ����____(����ĸ)��
A.��1+��2=1 B. Q1+Q2=Q C. ��3<��1 D. p3<2p1=2p2 E. n2<n3<1.0mol F. Q3=2Q1
(6)��һ�������½��з�Ӧ2SO2(g)��O2(g) ![]() 2SO3(g)����ͼ��ʾ��
2SO3(g)����ͼ��ʾ��
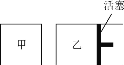
��ͬ�¶��£��ڼס����������и�Ͷ��2molSO2��1molO2���ס����������ij�ʼ�����Ϊ1L���ס��������ﵽƽ������ʱ�䣺��____(�>������<����=��,��ͬ)�ң�ƽ��ʱSO2��ת���ʣ���____�ҡ�