题目内容
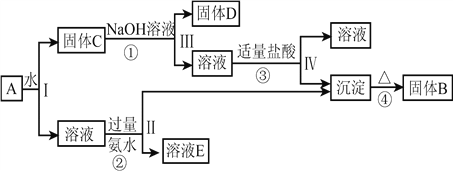
【题目】已知某溶液中含有Mg2+、Ba2+ 、Ag+和NO3-,现分别用NaCl溶液、NaOH溶液和Na2CO3溶液将溶液中三种阳离子逐一完全沉淀分离,其流程如右图所示。下列说法正确的是( )

A. 试剂A可能为NaOH溶液
B. 沉淀2只能是BaCO3 ,不可能是Mg(OH)2
C. 每加一种试剂需过量但不需要过滤即可进行下一步
D. 生成沉淀1的离子方程式只能是:Ag+ + Cl- = AgCl↓
【答案】D
【解析】由分离流程可知,溶液含有Ba2+、Mg2+、Ag+,应先加A为入NaCl,生成沉淀1为AgCl,过滤后溶液1中加试剂B为NaOH,可得到沉淀2为Mg(OH)2,最后溶液2中加入试剂C为Na2CO3,可得到沉淀3为BaCO3。
A、试剂A不可能为NaOH溶液,Ag+和Mg2+均产生沉淀,故A错误;B、沉淀2是Mg(OH)2,故B错误;C、除杂时,为了除尽杂质离子,所加入的除杂试剂必须过量,由于实验目的是将三种阳离子逐一沉淀分离,所以每步过滤后方可进行下一步,故C错误;D、生成沉淀1的离子方程式只能是:Ag++ Cl-=AgCl↓,故D正确;故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目