题目内容
(11分)下表是元素周期表短周期的一部分
| ① | | | ||||||
| | | | | ② | ③ | | ④ | |
| | ⑤ | ⑥ | ⑦ | | | | | |
(2)可作为半导体材料的是 (写元素符号)。
(3)表中元素⑥的原子结构示意图为 。
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 。
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。
⑴3,ⅡA ⑵Si ⑶ ⑷离子键
⑷离子键 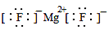
⑸⑤⑦②③① ⑹Al(OH)3+3H+=Al3++3H2O
解析试题分析:⑴在编号中第⑤号元素镁的金属性最强,其位置是第三周期第IIA族;
⑵在编号中第⑦号元素硅可作为半导体材料;
⑶元素⑥为铝,其原子序数为13,其原子结构示意图为 ;
;
⑷元素④为氟元素,元素⑤为镁,二者形成的化合物为MgF2,其含有离子键,其电子式为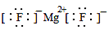 ;
;
⑸根据元素①、②、③、⑤、⑦在周期表中位置关系确定其原子半径由大到小的顺序是⑤>⑦>②>③>①;
⑹元素③、⑥它们最高价氧化物的水化物分别为HNO3、Al(OH)3,二者发生的化学反应为Al(OH)3+3HNO3=Al(NO3)3+3H2O,然后将其改写为离子方程式即可。
考点:考查元素周期表和元素周期律。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
下列叙述中,正确的是
| A.同周期元素中,ⅦA族元素的原子半径最大 |
| B.ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C.室温时,0族元素的单质都是气体 |
| D.元素周期表中,从ⅢB到ⅡB这10个纵行的元素都是副族元素 |
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | | | |
| 3 | ③ | ④ | ⑤ | ⑥ | | ⑦ | ⑧ | ⑩ |
| 4 | | | | | | | ⑨ | |
构成有机物的主要元素是 ,构成岩石与许多矿物的基本元素是 ,
化学性质最不活泼的元素 ,气态氢化物的水溶液呈碱性的元素 。
⑵上述①~⑨元素的最高价氧化物对应的水化物中:
碱性最强的物质的电子式为 ,酸性最强的物质的化学式为 。
⑶若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作______极(填“正”或“负”)
⑷元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体。若这两种气体混合,会生成一种淡黄色粉末。此反应化学方程式为 。若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为 (填数值)。
⑸元素⑧和元素⑨两者核电荷数之差是 ,这两种元素中非金属性较弱的元素是 (填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)
。
(9分)4种相邻的主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
| | | m | n |
| x | y | | |
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是______,碱性最强的是______.(填化学式)
(3)气体分子(mn)2的电子式为_______,(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是_____________________________。



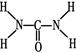 ,则尿素分子中C和N原子的杂化方式分别是、。
,则尿素分子中C和N原子的杂化方式分别是、。