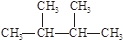题目内容
(6分)现有1—20号元素A、B、C、D所对应的物质的性质或微粒结构如下:
①A的原子,M层上有6个电子。②B的离子与D的离子具有相同电子层结构,且可以相互组合形成常见干燥剂。③元素C,常温下单质为双原子分子,其氢化物水溶液呈碱性④元素D,最高正价为+7价。请回答下列问题
(1)B的离子与D的离子相互组合形成的干燥剂的化学式是 。
(2)元素C与氢元素形成带一个单位正电荷的离子,写出该微粒的电子式(用元素符号表示) 。
(3)元素A与元素D相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a.常温下A的单质和D的单质状态不同 b.A的氢化物比D的氢化物稳定
c.一定条件下D单质能从A的氢化物水溶液中置换出A单质
d.HD的酸性比HA酸性强
C的氢化物固态时属于 晶体,该氢化物与A的最高价氧化物水化物反应的化学方程 式是 。
(6分)
(1)CaCl2(1分)
(2)电子式略 NH4+ (1分)
(3)Cl (1分) c(1分)
(4)分子 (1分)2NH3+H2SO4=(NH4)2SO4 (1分)
解析试题分析:由题A为S;B为Ca;C为N;D为Cl
(1)D最高价位+7价,与B形成常见的干燥剂为CaCl2;
(2)由题C为N,与H形成NH4+,电子式为;
(3)A与D,非金属性较强的是Cl,能证明这一事实的是C,一定条件下D单质能从A的氢化物水溶液中置换出A单质;
(4)C的氢化物固态时属于分子晶体,与硫酸反应的化学方程式为2NH3+H2SO4=(NH4)2SO4
考点:本题以元素周期律为基础,考元素及化合物、电子式、化学实验相关知识及化学方程式。

 阅读快车系列答案
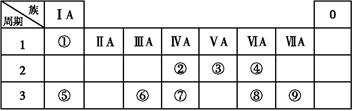
阅读快车系列答案根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
| A.由左至右第8、9、10三列元素中没有非金属元素 |
| B.第三、四、五、六周期元素的数目分别是18、18、32、32 |
| C.L电子层为奇数的所有元素都是非金属 |
| D.只有第ⅡA族元素的原子最外层有2个电子 |
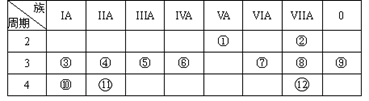
(11分)下表是元素周期表短周期的一部分
| ① | | | ||||||
| | | | | ② | ③ | | ④ | |
| | ⑤ | ⑥ | ⑦ | | | | | |
(2)可作为半导体材料的是 (写元素符号)。
(3)表中元素⑥的原子结构示意图为 。
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 。
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。

 ③白磷 ④18O ⑤
③白磷 ④18O ⑤