题目内容
19.电镀厂镀铜废水中含有CN-和Cr2O72-,需要处理达标后才能排放.该厂拟定下列流程进行废水处理: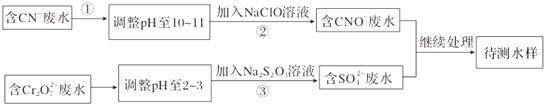
回答下列问题:
(1)上述处理废水流程中主要使用的方法是氧化-还原法.
(2)②中反应后无气体放出,该反应的离子方程式为CN-+ClO-═CNO-+Cl-.
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应的离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因:因为待检水样中还有Cu2+,Ksp(CuS)<Ksp[Cu(OH)2],所以Cu2++2OH-═Cu(OH)2↓再加Na2S溶液,蓝色沉淀转化成黑色沉淀Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法.该法是向废水中加入FeSO4•7H2O,将Cr2O72-原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCrⅢ2-x]O4(铁氧磁体,罗马数字表示元素价态)的沉淀.处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,下列结论正确的是D.
A.x=0.5,a=8 B.x=0.5,a=10
C.x=1.5,a=8 D.x=1.5,a=10.
分析 流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样;
(1)从流程分析物质的转化关系和试剂选择分析所用方法;
(2)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
(3)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(4)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析;
(5)根据氧化还原反应中得失电子数相等,再结合原子守恒进行计算.
解答 解:(1)从流程看,CN-转化为CNO-,化合价升高被氧化剂氧化,Cr2O72-转化为Cr3+化合价降低,故还原剂还原,故采用方法为氧化-还原法;
故答案为:氧化-还原法;
(2)步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
(3)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(4)待检水样中还有Cu2+,加碱铜离子与氢氧根离子反应Cu2++2OH-═Cu(OH)2↓,CuS比Cu(OH)2更难溶,则加入Na2S溶液能发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq),使沉淀向更难溶方向转化,
故答案为:因为待检水样中还有Cu2+,Ksp(CuS)<Ksp[Cu(OH)2],所以Cu2++2OH-═Cu(OH)2↓再加Na2S溶液,蓝色沉淀转化成黑色沉淀Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq);
(5)处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成 $\frac{2}{2-x}$molFeⅡ[FeⅢx•CrⅢ2-x]O4,根据铁原子守恒得amol=$\frac{2(1+x)}{2-x}$mol①,该反应中得失电子数相等,1mol×2×3=$\frac{2}{2-x}$mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10,
故答案为:D.
点评 本题考查了氧化还原反应,沉淀溶解平衡知识,注重了化学与实际生产的联系,学生应学会利用物质的性质、得失电子守恒和原子守恒计算等来解答,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 绝对不溶解的物质是不存在的 | |
| B. | 不溶于水的物质其溶解度为零 | |
| C. | 某离子被沉淀完全,则该离子在溶液中的浓度为零 | |
| D. | 物质的溶解性为难溶,则该物质不溶于水 |
| A. | 为+3价 | B. | 位于第IA族 | ||
| C. | 位于第三周期 | D. | 离子半径大于其原子半径 |
| A. | 可以用淀粉溶液检验加碘盐中是否含碘元素 | |
| B. | 水晶、玛瑙的主要成分是二氧化硅 | |
| C. | “白色污染”是指由不可降解的塑料造成的环境污染 | |
| D. | 硫和氮的氧化物是形成酸雨的主要物质 |
| A. | ?乙烯使溴的四氯化碳溶液褪色 | |
| B. | ?乙烯通入酸性高锰酸钾溶液中 | |
| C. | ?在镍做催化剂的条件下,苯与氢气反应 | |
| D. | ?苯与液溴混合后撒入铁粉 |
| A. | 降低体系温度 | B. | 增大体系容积 | C. | 移去SO3 | D. | 通入O2 |
| A. | 铝片投入烧碱溶液Al+2OH-═AlO2-+H2↑ | |
| B. | 氯气与水反应Cl2+H2O?2H++Cl-+ClO- | |
| C. | 碳酸钙溶于盐酸CO32-+2H+═H2O+CO2↑ | |
| D. | 金属钠跟水反应2Na+2H2O═2Na++2OH-+H2↑ |
①升温 ②改变反应物浓度 ③增加生成物浓度 ④加压.
| A. | ①②③ | B. | ①③ | C. | ②③ | D. | ①②③④ |