题目内容
【题目】过氧化钙晶体(CaO2·8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
![]()
下列有关说法正确的是
A. ①煮沸的主要目的是为了除去溶解的CO2
B. ②的反应中H2O2作氧化剂,氨水用来调节溶液的pH
C. ②中结晶的颗粒较小,过滤时可用玻璃棒轻轻搅动
D. ③醇洗的主要目的是为了减少晶体的损失
【答案】D
【解析】
A.碳酸钙能与盐酸反应生成氯化钙、水和二氧化碳,气体在溶液中的溶解度随温度的升高而减小,加热煮沸是为了除去多余的盐酸,反应方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;A错误;
B.向CaCl2溶液中加入H2O2、NH3H2O,发生反应:CaCl2+H2O2+2NH3H2O+6H2O=CaO28H2O↓+2NH4Cl,H2O2的组成元素化合价没有发生变化,因此没有发生氧化还原反应,B错误;
C.尽管②中结晶的颗粒较小,但是过滤时若用玻璃棒轻轻搅动,会导致滤纸破损,过滤失败,所以不能搅动,C错误;
D.过氧化钙晶体(CaO2·8H2O) 微溶于水,也不溶于乙醇,用醇洗涤,可以减少晶体的溶解,同时乙醇容易挥发,可以加速晶体干燥,D正确;
故合理选项是D。

【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
(1)以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H=+49 kJmol-1
CO2(g)+3H2(g) △H=+49 kJmol-1
副反应:H2(g)+CO2(g)![]() CO(g)+H2O(g) △H=+41 kJmol-1
CO(g)+H2O(g) △H=+41 kJmol-1
①甲醇在催化剂作用下裂解可得到H2和CO,则该反应的化学方程式为_________________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②分析适当增大水醇比(nH2O∶nCH3OH)对甲醇水蒸气重整制氢的好处_________________________。
③某温度下,将nH2O∶nCH3OH =1∶1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________________。(忽略副反应)
(2)工业常用CH4 与水蒸气在一定条件下来制取H2,其原理为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+203kJ·mol-1
①该反应的逆反应速率表达式为; V逆=k·c(CO)·c3(H2),k为速率常数,在某温度下,测得实验数据如表:
CO浓度(mol·L-1) | H2浓度(mol·L-1) | 逆反应速率(mol·L-1·min-1) |
0.05 | C1 | 4.8 |
c2 | C1 | 19.2 |
c2 | 0.15 | 8.1 |
由上述数据可得该温度下,上述反应的逆反应速率常数k 为__________L3·mol-3·min-1。
②在体积为3L的密闭容器中通入物质的量均为3mol 的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示,则压强Pl_____P2(填“大于”或“小于”)温度T3_______T4(填“大于”或“小于”);压强为P1时,在N点; v正_______v逆(填“大于”或“小于”或“等于”)。求N点对应温度下该反应的平衡常数 K=_____________________。

【题目】某同学探究 Cu 与 NO 的反应,查阅资料:①Cu 与 NO 反应可生成 CuO 和 N2,②酸性条件下,NO 或 NO2–都能与 MnO4–反应生成 NO3–和 Mn2+
(1)实验室利用Cu和稀 HNO3 制备 NO,写出反应的化学方程式____。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略) 实验开始前,向装置中通入一段时间的N2。回答下列问题:
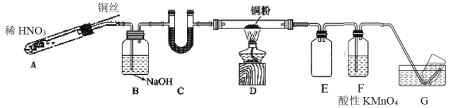
①使用铜丝的优点是____装置 E 的作用为____。
②装置 C 中盛放的药品可能是____;
③装置 D 中的现象是____;装置 F 中反应的离子方程式是____。
(3)测定NaNO2 和 NaNO3混合溶液中NaNO2的浓度。取 25.00mL混合溶液于锥形瓶中,用0.1000mol·L-1 酸性 KMnO4 溶液进行滴定,实验所得数据如表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗 KMnO4 溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是____(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.因为没有一直观察锥形瓶中溶液颜色变化,判断滴定终点时溶液已变红d.酸性 KMnO4 溶液中含有其他氧化性试剂e.锥形瓶洗净后用待测液润洗
②酸性 KMnO4溶液滴定亚硝酸钠溶液的离子方程式为____。
③NaNO2的物质的量浓度为____
【题目】三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.8 | 5.8 | 3.0 | 7.1 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 | 9.2 |
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有①适当升高温度;②搅拌;③________等。
(2)酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。沉镍前需加Na2CO3控制溶液pH范围为____________________。
(3)从滤液A中可回收利用的主要物质是Na2CO3和________。
(4)“氧化”生成Ni2O3的离子方程式为__________________________________。
(5)工业上用镍为阳极,电解0.05~0.1 mol·L-1 NiCl2溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示,则①NH4Cl的浓度最好控制为__________________________。

②当NH4Cl的浓度大于15g·L-1时,阴极有气体生成,导致阴极电流效率降低,写出相应的电极反应式:________________________。
(6)如果在“沉镍”步骤把Na2CO3改为加草酸,则可以制得草酸镍晶体(NiC2O4·2H2O)。草酸镍晶体在热空气中干燥脱水后在高温下煅烧三小时,可以制得Ni2O3,同时获得混合气体。草酸镍晶体受热分解的化学方程式为___________________________________。



