题目内容
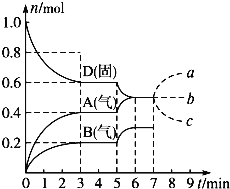
【题目】甲烷与氧气反应过程中的能量变化如图所示。下列有关说法中正确的是( )

A.CH4(g)的能量大于CO2(g)和H2O(g)的能量总和
B.反应CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-800kJmol-1
C.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1molC-H键需吸收热量415kJ
D.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g)中,放出热量400kJ,有1molO-H键生成
【答案】C
【解析】
从图中可以提取以下信息:1molCH4(g)+2molO2(g)断裂所有共价键,需要吸收2646kJ的热量;1molC(g)+4molH(g)+4molO(g)结合成1molCO2(g)+2molH2O(g),能放出3446kJ的热量。
A.从图中看出,CH4(g)和O2的总能量大于CO2(g)和H2O(g)的能量总和,但CH4(g)的能量不一定大于CO2(g)和H2O(g)的能量总和,A不正确;
B.图中信息告诉我们,反应CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-800kJmol-1,B不正确;
C.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1molC-H键需吸收热量![]() kJ=415kJ,C正确;
kJ=415kJ,C正确;
D.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g)中,放出热量400kJ,则生成1molH2O,有2molO-H键生成,D不正确;
故选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目