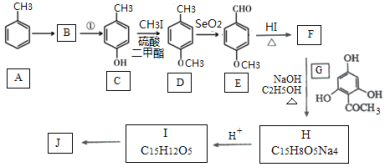
题目内容
【题目】配合物Fe(CO)5的熔点一20℃,沸点103℃。可用于制备纯铁。Fe(CO)5的结构如图所示。
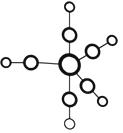
(1)基态Fe原子的价电子排布式是_____________________;Fe(CO)5晶体类型属于__________晶体。
(2)CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式是________,写出与CO互为等电子体的分子的电子式:___________________。
(3)C、O、Fe的第一电离能由大到小的顺序为_______________________。
(4)关于Fe(CO)5,下列说法正确的是______。
A. Fe(CO)5是非极性分子,CO是极性分子 B. Fe(CO)5中Fe原子以sp3杂化方式与CO成键
C.1molFe(CO)5含有10mol配位键 D.Fe(CO)5==Fe+5CO反应中没有新化学键生成
(5)铁的三种晶体的晶胞均为立方晶胞,三种晶体的晶胞如下图所示。
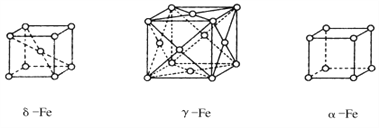
①上述三种晶体的晶胞中属于面心晶胞的是______(填“a”“δ””或“γ”)-Fe。
②a-Fe晶胞中铁原子的配位数为_______________。
③γ-Fe晶胞的边长为apm,则γ-Fe单质的密度为____g/cm3(NA表示阿伏伽德罗常数的值,列出计算式即可)。
【答案】 3d64s2 分子 C![]() O
O ![]() O>C>Fe A、C γ 6 ρ=(224/a3·NA)×1030(或ρ=[4×56/a3·NA]×1030)
O>C>Fe A、C γ 6 ρ=(224/a3·NA)×1030(或ρ=[4×56/a3·NA]×1030)
【解析】(1)铁为26号元素,基态Fe原子的价电子排布式为3d64s2;Fe(CO)5的溶点-20℃,沸点103℃,熔沸点较低,Fe(CO)5晶体属于分子晶体,故答案为:3d64s2;分子;
(2) CO分子中C、O原子都满足8电子稳定结构,CO分子的结构式为C≡O,与CO互为等电子体的分子有N2,故答案为:C≡O;N2;
(3)C、O、Fe三种元素的原子中铁的原子半径最大,Fe原子的价电子排布式为3d64s2,失去1个电子生成3d54s2,结构更稳定,第一电离能最小,C、O是同一周期元素,同一周期,从左到右,第一电离能逐渐增大,第一电离能由大到小的顺序为O>C> Fe,故答案为:O>C> Fe;
(4)A.根据Fe (CO)5的结构可知, Fe(CO)5为三角双锥结构,分子中正负电荷分布均匀,是非极性分子,CO中正负电荷分布不均匀,是极性分子,故A正确;B.Fe(CO)5中Fe原子与5个CO成键,不是sp3杂化,故B错误;C. 1molFe(CO)5 中Fe原子与5个CO形成5个配位键,在每个CO分子中存在1个配位键,共含有10mol配位键,故C正确;D. Fe(CO)5=Fe+5CO属于化学变化,包括化学键的断裂与形成,断开了分子中的配位键,形成了金属键,故D错误;故选AC;
(5)①根据晶胞结构图,三种晶体的晶胞中属于面心晶胞的是γ,故答案为:γ;
②α晶胞中晶胞顶点的铁原子与周围的6个铁原子距离相等且最小,配位数为6,故答案为:6;
③γ晶体晶胞的边长为a pm,1个晶胞中含有的铁原子数目=8×![]() +6×
+6×![]() =4,则γ-Fe单质的密度=
=4,则γ-Fe单质的密度=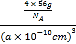 =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】甲、乙两同学用一种标准盐酸去测定同一种未知浓度的NaOH溶液的浓度,但操作不同;甲把一定体积的NaOH溶液放入锥形瓶,把标准盐酸放入滴定管进行滴定;乙把一定体积的标准盐酸放入锥形瓶,把未知液NaOH溶液放入滴定管进行滴定。
(1)甲同学使用的是_______滴定管,乙同学使用的是________滴定管。
(2)甲同学的滴定管在用蒸馏水洗净后没有用标准盐酸润洗,乙同学的滴定管在用蒸馏水洗净后也没有用待测NaOH溶液润洗,其余操作均正确,这样甲同学测定结果________(偏大、偏小、无影响,下同),乙同学测定结果__________。
(3)乙同学选择酚酞作指示剂进行试验,如何来判断滴定终点:____________。
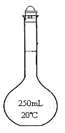
(4)甲同学根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据计算c(NaOH)=______________。