题目内容
10.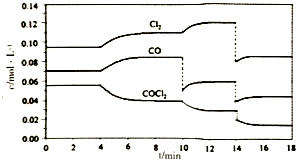 光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )
光气的分解反应为:COCl2(g)?Cl2(g)+CO(g)△H>0,反应体系达平衡后,各物质的浓度在不同条件下的变化状况如图所示,则下列说法正确的是( )| A. | 从第10min到第12min时,生成Cl2的速率v(Cl2)=0.01mol•L-1•min-1 | |
| B. | 第8min时与第18min时反应的平衡常数相同 | |
| C. | 由于10min时条件的改变,使COCl2的转化率降低 | |
| D. | 在第14min时,改变的条件可能是压缩反应容器的体积 |
分析 A、根据图象中Cl2在10~12 min时浓度变化为0.01mol/L,据V=$\frac{△c}{△t}$进行计算;
B、根据平衡常数仅与温度有关来判断;
C、由图可知,10min时CO浓度突然减小,Cl2没变,改变条件是减少CO浓度;
D、14min时改变条件,是增大体积,降低压强.
解答 解:A、根据图象中Cl2在10~12 min时浓度变化为0.01mol/L,所以Cl2在10~12 min时平均反应速率V=$\frac{△c}{△t}$=$\frac{0.01mol}{2min}$=0.005mol•L-1•min-1,故A错误;
B、根据C、D的分析说明第8 min时与第18 min时温度没变,所以平衡常数不变,故B正确;
C、由图可知,10min时CO浓度突然减小,Cl2没变,改变条件是减少CO浓度,减少生成物的浓度平衡正移,所以COCl2的转化率增大,故C错误;
D、14min时反应物和生成物浓度都瞬间变小,所以改变的条件应是增大体积,降低压强,故D错误;
故选B.
点评 本题考查化学平衡图象、平衡常数、化学平衡与反应速率的影响因素,题目难度中等,根据平衡常数与改变条件的瞬间各物质的浓度变化判断条件是解题的关键.

练习册系列答案
相关题目
2.已知,将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3 ,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关,当n(KOH)=a mol时,下列有关说法错误的是( )
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{{O}_{3}}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量小于$\frac{1}{2}$a mol | |
| C. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$a mol≤ne≤$\frac{5}{6}$a mol | |
| D. | 改变温度,产物中KC1O3的最大理论产量为$\frac{1}{7}$a mol |
5.某有机物X的结构简式如下图所示,则下列有关说法中正确的是( )
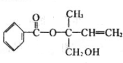

| A. | 有机物X的含氧官能团有3种 | |
| B. | X分子中苯环上的一氯取代物有3种 | |
| C. | 在Ni作催化剂的条件下,1mol X 最多能与5 mol H2加成 | |
| D. | X在一定条件下能发生加成、取代、消去等反应 |
15.化学与生活密切相关,下列说法正确的是( )
| A. | 绿色食品是只指纯天然食品,不含任何化学物质 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 为消除碘缺乏病,政府规定在食盐中必须添加一定量的KI | |
| D. | 只要带专用口罩,就不怕雾霾天气对人体产生伤害 |
19.常温下,将一定量的氯气通入100mL 4mol/L的氢氧化钠溶液中,发生反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O.充分反应后,下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 当通入的Cl2为2.24 L时,反应中电子转移数目为0.1 NA | |
| B. | 当溶液中Na+为0.4 NA时,溶液中的Cl-为0.2 NA | |
| C. | 当电子转移数目为0.2 NA时,溶液质量增加14.2 g | |
| D. | 当溶液质量增加7.1 g时,溶液中ClO-为0.1 NA |
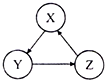 下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( )
下列各组物质,不能按照图关系相互转化的是(“→”表示反应一步完成)( ) A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,且均为气体,转化关系如图所示(图中部分产物及条件已略去).A的大量人工合成是化学对人类社会的卓越贡献之一,请回答: 现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F、G原子序数依次增大的七种元素,它们位于元素周期表的前四周期.B元素含有3个能级,且每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;在这七种元素中E元素原子半径最大,A原子半径最小;F元素与G元素处于同一周期相邻的族,它们的原子序数相差3,且F元素的基态原子有4个未成对电子.请回答下列问题: