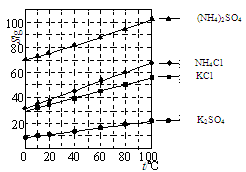
题目内容
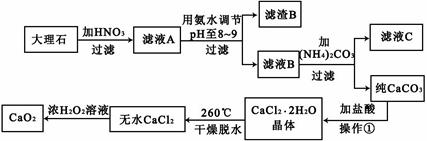
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用___________________。
(2)脱色槽中应加入的物质X是_______________;设备A的作用是______________;设备B的名称为________________;设备C的作用是____________________。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是_____________。反应的化学方程式为_________________。
| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
(5)氯碱工业电极方程式_____________________。
(1)盐酸
(2)活性炭 蒸发浓缩 过滤器 脱水干燥
(3)C Ca(OH)2+H2S=CaS+2H2O
(4)对母液回收利用,降低废弃物排放量,提高经济效益
(5)阴极2H++2e-=H2↑。阳极 2Cl--2e-=Cl2↑。
解析试题分析:(1)因为用电石浆制取无水氯化钙,所以在反应器中加入的酸应选用非氧化性的盐酸。(2)在脱色槽中应加入的物质X是由吸附作用的活性炭。活性炭因为有吸附作用而使物质脱色。过滤器把沉淀过滤除去,得到的滤液在设备A中蒸发浓缩得到氯化钙晶体,再把氯化钙晶体过滤出来,在设备C中的HCl的气氛中脱水干燥得到无水氯化钙。(3)废气H2S是大气污染物。要将其通入吸收池,由于该气体的水溶液呈碱性,所以下列物质中最适合作为吸收剂的是石灰乳。选项为C.反应的化学方程式为Ca(OH)2+ H2S =CaS+2H2O (4)将设备B中产生的母液重新引入反应器的目的是对母液回收利用,降低废弃物排放量,提高经济效益(5)氯碱工业的总方程式为:2NaCl+2H2O 2NaOH+ H2↑+ Cl2↑。其中的电极方程式为:阴极2H++2e-=H2↑。阳极 2Cl--2e-=Cl2↑。
2NaOH+ H2↑+ Cl2↑。其中的电极方程式为:阴极2H++2e-=H2↑。阳极 2Cl--2e-=Cl2↑。
考点:考查用氯碱工业中的一种废弃物电石浆来生成无水氯化钙的反应原理。主要包括试剂的选择、仪器的名称及作用、化学反应方程式及电极反应式的书写及物质的循环利用的知识。


 溶液中发生反应的化学方程式为 。
溶液中发生反应的化学方程式为 。
 ,而不用MgO,其原因是
,而不用MgO,其原因是
 溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。




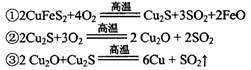
 )可制备Fe2O3。根据流程回答下列问题:
)可制备Fe2O3。根据流程回答下列问题: