题目内容
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。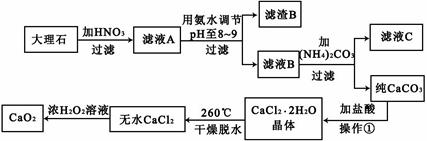
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
(1)除去Fe3+ ; (2)是 ;(3)<;
(4)CaCl2+H2O2 CaO2+2HCl(或CaCl2+H2O2+2NaOH = CaO2↓+2NaCl+2H2O); 加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成。
CaO2+2HCl(或CaCl2+H2O2+2NaOH = CaO2↓+2NaCl+2H2O); 加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成。
解析试题分析:根据图示信息,可得出:滤液A的成分有硝酸钙和硝酸铁以及剩余的硝酸,当pH至8-9范围段内时,三价铁可易形成沉淀,所以滤渣B是氢氧化铁,滤液B是硝酸钙,和碳酸铵之间可以发生复分解反应生成碳酸钙和硝酸铵,过滤,沉淀碳酸钙用盐酸溶解然后蒸发结晶可以得到氯化钙晶体,再失水成为无水氯化钙,双氧水可以和氯化钙反应生成过氧化钙和盐酸.
(1)用氨水调节pH至8-9,三价铁可易形成沉淀,从而分离出硝酸钙溶液,故答案为:除去Fe3+;
(2)若测得滤液C中c(CO32-)=10-3 mol/L,Ksp(CaCO3)=4.96×10-9;Ksp=Ca2++CO32-=10-3 mol/L×c(Ca2+)=4.96×10-9 ,c(Ca2+)=4.96×10-6 mol/L,已知c(Ca2+)≤10-5mol/L可视为沉淀完全,所以此时钙离子沉淀完全;故答案为:是;
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,铵根离子水解,则酸化后溶液中c(NH4+)<c(NO3-);故答案为:<;
(4)双氧水可以和氯化钙反应生成过氧化钙和盐酸,即CaCl2+H2O2=CaO2↓+2HCl,加入NaOH溶液使上述平衡向正反应方向,有利于CaO2沉淀的生成;
考点:溶液酸碱性的分析和控制目的

某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:
已知:[Cu(NH3)4]2+(aq)  Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
| A.气体X中含有SO2 |
| B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可 |
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O CuO + 2HCl↑+ 4NH3↑ CuO + 2HCl↑+ 4NH3↑ |
| D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低 |
电石浆是氯碱工业中的一种废弃物,其大致组成如下表所示:
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
已知氯化钙晶体的化学式是:CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用___________________。
(2)脱色槽中应加入的物质X是_______________;设备A的作用是______________;设备B的名称为________________;设备C的作用是____________________。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是_____________。反应的化学方程式为_________________。
| A.水 | B.浓硫酸 | C.石灰乳 | D.硝酸 |
(5)氯碱工业电极方程式_____________________。
合成氨工业上采用循环操作的原因主要是( )
| A.加快反应速率 |
| B.能提高NH3的平衡浓度 |
| C.降低NH3的沸点 |
| D.提高N2和H2的利用率 |



 2I-+S4O62-)
2I-+S4O62-)



 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。