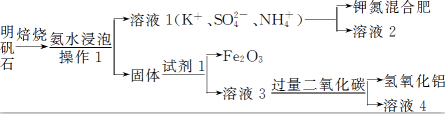
题目内容
8.分类是科学研究的重要方法,下列物质分类不正确的是( )| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 同素异形体:活性炭,C60,C80,金刚石 | |
| C. | 非电解质:乙醇,四氯化碳,氯气,葡萄糖 | |
| D. | 混合物:漂白粉,纯净矿泉水,盐酸,石灰石 |
分析 A.由两种以上元素组成的纯净物是化合物;
B.由同种元素组成不同单质;
C.在水溶液中和熔融状态下都不导电的化合物;
D.由两种以上物质组成的物质.
解答 解:A.干冰,冰水混合物,烧碱,小苏打都是由两种以上元素组成的纯净物是化合物,故A正确;
B.活性炭,C60,C80,金刚石都是碳元素组成的不同单质,互为同素异形体,故B正确;
C.氯气是单质,不是非电解质,故C错误;
D.漂白粉,纯净矿泉水,盐酸,石灰石都含有两种以上物质,属于混合物,故D正确;
故选:C.
点评 本题考查了化学基本概念,涉及化合物、混合物、非电解质、同素异形体,熟悉概念的含义是解题关键,题目难度不大,注意非电解质必须是化合物.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
18.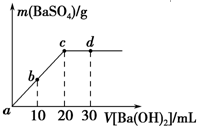 常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
 常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )
常温下,向0.25mol•L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中不正确的是( )| A. | 硫酸溶液的体积为20mL | |
| B. | b时刻溶液中SO${\;}_{4}^{2-}$的浓度约为0.083mol•L-1 | |
| C. | d时刻溶液的pH为12 | |
| D. | 反应的离子反应方程式为Ba2++SO4-+2H++2OH-═BaSO4↓+2H2O |
13.下列说法正确的是( )
| A. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO32-+2I-+4H+ | |
| C. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性 |
17.影响水的电离平衡的因素,观察下表的数据:
(1)从以上数据中发现什么递变规律?随着温度的升高,KW的值增大
(2)以上数据说明温度与水的电离程度之间存在什么关系?
[小结]:在H2O?H++OH-:
升高温度,水的电离程度增大,水的电离平衡向正向移动,KW增大.
降低温度,水的电离程度减小,水的电离平衡向逆向移动,KW减小.
| t(℃) | 0 | 10 | 20 | 25 | 40 | 50 | 90 | 100 |
| Kw/10-14 | 0.134 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 38.0 | 55.0 |
(2)以上数据说明温度与水的电离程度之间存在什么关系?
[小结]:在H2O?H++OH-:
升高温度,水的电离程度增大,水的电离平衡向正向移动,KW增大.
降低温度,水的电离程度减小,水的电离平衡向逆向移动,KW减小.
18.关于阿伏加德罗常数的说法中错误的是( )
| A. | 我们把0.012kg12C中所含的碳原子个数叫做阿伏加德罗常数 | |
| B. | 含的原子总数为6.02×1023个的CO,其物质的量为1mol | |
| C. | 凡是含有阿伏加德罗常数个微粒的集体,其物质的量就为1mol | |
| D. | 阿伏加德罗常数通常取6.02×1023mol-,常用NA表示 |