题目内容
20.铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用.(1)二氧化铈(Ce02)在平板电视显示屏中有着重要应用.CeO2在稀硫酸和Hzoz的作用下可
生成Ce3+,Ce02在该反应中作氧化 剂.
(2)自然界Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬.完成并配平下列离子方程式:
1Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是4Na+TiCl4═Ti+4NaCl.
(4)NiS04.xH20是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:

①向滤液I中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为FeS+Cu2+=CuS+Fe2+.
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是除去Fe3+,此空删去.
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是增大NiSO4浓度,有利于蒸发结晶.
④为测定NiSO4.xH2O晶体中x的值,称取26.3g晶体加热至完全失去结晶水,剩余固体15.5g,则x的值等于6.
分析 (1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2中的Ce是+4价,在H2O2的作用下可生成Ce3+,因此发生还原反应,CeO2在该反应中作氧化剂;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;结合原子守恒和电荷守恒配平书写离子方程式;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,依据原子守恒书写;
(4)①FeS除去Cu2+的反应是沉淀的转化;
②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,然后调pH沉淀Fe3+;
③NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
④26.3g晶体加热至完全失去结晶水,剩余固体15.5g,失去水的质量=26.3g-15.5g=10.8g,NiSO4的质量为15.5g,计算物质的量得到1:x=$\frac{15.5g}{155g/mol}$:$\frac{10.8g}{18g/mol}$,计算得到x;
解答 解:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2中的Ce是+4价,在H2O2的作用下可生成Ce3+,因此发生还原反应,CeO2在该反应中作氧化剂,
故答案为:氧化;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;反应的离子方程式:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O,
故答案为:1,3,8H+,2,3,4;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,反应的化学方程式为:4Na+TiCl4═Ti+4NaCl,
故答案为:4Na+TiCl4═Ti+4NaCl;
(4)①FeS除去Cu2+的反应是沉淀的转化,反应的离子方程式为:FeS+Cu2+=CuS+Fe2+,
故答案为:FeS+Cu2+=CuS+Fe2+;
②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,然后调pH使Fe3+完全沉淀,
故答案为:除去Fe3+;
③NiSO4与Na2CO3反应生成NiCO3沉淀,然后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶,
故答案为:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4);
④测定NiSO4•xH2O晶体中x的值,称取26.3g晶体加热至完全失去结晶水,剩余固体15.5g,失去水的质量=26.3g-15.5g=10.8g,NiSO4的质量为15.5g,计算物质的量得到1:x=$\frac{15.5g}{155g/mol}$:$\frac{10.8g}{18g/mol}$,解得x=6,
故答案为:6.
点评 本题考查了金属及其化合物性质,题目难度中等,主要考查氧化还原反应的离子方程式书写方法和产物判断,注意掌握常见金属及其化合物性质,掌握基础是关键.

| A. | 选择萃取剂将碘从碘水中萃取出来,这种萃取剂应具备的性质是不溶于水,且比水的密度大 | |
| B. | 选择萃取剂将碘从碘水中萃取出来,这种萃取剂应具备的性质是不溶于水,且比水的密度小 | |
| C. | 在使用分液漏斗进行分液时,上层液体经漏斗下口放出 | |
| D. | 选择萃取剂将碘从碘水中萃取出来,碘在四氯化碳中的溶解度比在水中的溶解度大 |
| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 同素异形体:活性炭,C60,C80,金刚石 | |
| C. | 非电解质:乙醇,四氯化碳,氯气,葡萄糖 | |
| D. | 混合物:漂白粉,纯净矿泉水,盐酸,石灰石 |
| A. | 金属钠着火可用干燥沙土扑灭 | |
| B. | 地沟油经处理后可用作生物柴油 | |
| C. | 糖类、油脂、蛋白质均为高分子化合物 | |
| D. | 氢氧化铁胶体的分散质粒子能通过滤纸孔隙 |
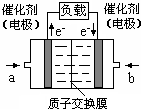 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法不正确的是( )| A. | 右电极为电池正极,b处通入的物质是空气 | |
| B. | 左电极为电池负极,a处通入的物质是空气 | |
| C. | 负极反应式为:CH3OH+H2O-6e-=CO2+6H+ | |
| D. | 正极反应式为:O2+4H++4e-=2H2O |
| A. | 溶液中溶质粒子不带电,胶体分散质粒子带电 | |
| B. | 溶液中溶质的粒子运动有规律,胶体粒子运动无规律 | |
| C. | 通直流电后,溶液中溶质的粒子分别向两极运动,而胶体中分散质的粒子向某一极运动 | |
| D. | 溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现光亮的“通路” |
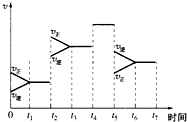 有A气体和B气体在一定条件下在一密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0
有A气体和B气体在一定条件下在一密闭容器中发生如下反应:A(g)+3B(g)?2C(g)△H<0