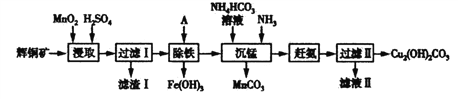
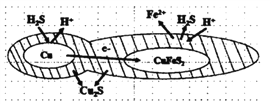
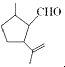
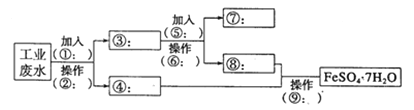
题目内容
【题目】某温度时,使用一对石墨电极电解饱和Na2SO4溶液,当转移2mol电子时停止电解,析出Na2SO410H2O晶体m g,所有数据都在相同温度下测得,下列叙述正确的是( )
A.电解后溶液质量减少(m+36)g
B.原溶液中Na2SO4的质量分数为 ![]()
C.若其它条件不变,将石墨电极替换为铜电极,则阴极析出2mol H2
D.若其它条件不变,将石墨电极替换为铜电极,则析出Na2SO4?10H2O晶体仍为m g
【答案】B
【解析】解:用石墨电极电解饱和硫酸钠溶液时,阳极上生成氧气、阴极上生成氢气,所以实质上是电解水,当电解1mol水时转移2mol电子,所以当转移2mol电子时生成实际上是电解1mol水,其质量为18g, A.电解后溶液质量减少量=电解水的质量+析出晶体质量=(18+m)g,故A错误;
B.析出硫酸钠的质量= ![]() =
= ![]() mg,溶液质量=(18+m)g,溶液质量分数=
mg,溶液质量=(18+m)g,溶液质量分数= ![]() =
= ![]() =
= ![]() ,故B正确;
,故B正确;
C.若其它条件不变,将石墨电极替换为铜电极,阴极上仍然是氢离子放电生成氢气,但阳极上Cu失电子生成铜离子,阴极析出1mol H2 , 故C错误;
D.若其它条件不变,将石墨电极替换为铜电极,阳极上生成铜离子、阴极上生成氢气同时还有OH﹣生成,铜离子和OH﹣反应生成Cu(OH)2沉淀,其电池反应式为Cu+2H2O ![]() Cu(OH)2↓+H2↑,根据方程式知,转移2mol电子时消耗2mol水,则析出Na2SO410H2O晶体为2m g,故D错误;
Cu(OH)2↓+H2↑,根据方程式知,转移2mol电子时消耗2mol水,则析出Na2SO410H2O晶体为2m g,故D错误;
故选B.

【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品.将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要 .
(2)取10.00mL待测液,用量取.
(3)用0.2010molL﹣1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视的现象时即到达滴定终点.
(4)根据下列数据,计算待测烧碱溶液的纯度: . (保留四位有效数字)
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(5)以下操作会造成测量结果偏高的是 ①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管.