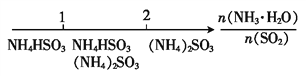��Ŀ����
����Ŀ���û�ͭ��(��Ҫ�ɷ�ΪCu2S��������Fe2O3��SiO2������)�Ʊ���ʽ̼��ͭ���������£�
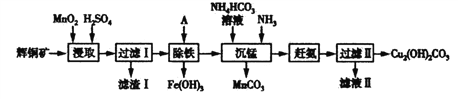
(1)��ͭ����ͭԪ�صļ�̬Ϊ_________________��
(2)������ijɷֳ��˲����Կ����⣬����S��__________��______________��д������ȡ������������S �����ӷ���ʽ_______________________��
(3)Ҳ����FeCl3����MnO2����ȡ��������FeCl3��ȡҺ�м���CuCl2 ���ܼӿ�ͭԪ�صĽ�ȡ���ʣ��ù��̵ķ�Ӧԭ�����û�ѧ����ʽ��ʾΪ����Cu2S+2CuCl2=4CuCl+S����____________��
(4)�����̡�ʱ�����ķ�Ӧ�����ӷ���ʽΪ____________________��
(5)��Һ�ᾧ�õ�������Ҫ��____________(�ѧʽ����ͬ)�������п�ѭ����������_________________��
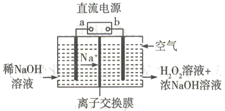
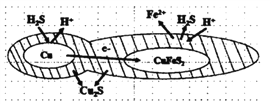
(6)��ͭ����ɻ�ͭ��(��Ҫ�ɷ�ΪCuFeS2)ͨ���绯ѧ��Ӧת����ɣ��й�ת������ͼ��ת��ʱ�����ĵ缫 ��ӦʽΪ___________________��
���𰸡� +l SiO2 MnO2 2MnO2+Cu2S+8H+=S��+2Cu2++2Mn2++4H2O CuCl+FeCl3=CuCl2+FeCl2 Mn2++2HCO3-=MnCO3��+H2O+CO2����Mn2++NH3+HCO3-=MnCO3��+NH4+ (NH4)2SO4 NH3 Cu+H2S-2e-=Cu2S��+2H+
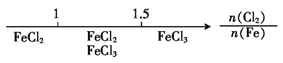
�����������̷�������ͭ����Ҫ�ɷ�ΪCu2S��������Fe2O3��SiO2�����ʣ�����ϡ����Ͷ������̽�ȡ��Fe2O3�����ᷴӦת��ΪFe3+��SiO2���ܣ��������������ݣ�2����֪S�������ɣ���֪Cu2S��MnO2������ת��ΪCu2+��S��MnO2��������ԭΪMn2+�����˵õ�����ΪSiO2��S��δ��Ӧ���MnO2����Һ�к���Fe3+��Mn2+��Cu2+��������ҺpH��ȥFe3+������̼�������Һ�Ͱ�����Mn2+����Ϊ̼���̣����˵õ���Һ���ϳ�����ѭ��ʹ�ã��õ���ʽ̼��ͭ��
��1��Cu2S��CuΪ+1�ۣ�
��2��������������������ijɷֻ���SiO2��MnO2��Cu2S��MnO2������ת��ΪCu2+��S��MnO2��������ԭΪMn2+������ʽΪ��2MnO2+Cu2S+8H+=S��+2Cu2++2Mn2++4H2O��
�ʴ�Ϊ��SiO2��MnO2��2MnO2+Cu2S+8H+=S��+2Cu2++2Mn2++4H2O��
��3��MnO2������������������FeCl3Ҳ��ǿ�����ԣ���������Cu2S������FeCl3��ȡҺ�м���CuCl2��������Ӧ��Cu2S+2CuCl2=4CuCl+S��CuCl�ٱ�FeCl3������ΪCuCl2����ѧ����ʽΪ��CuCl+FeCl3=CuCl2+FeCl2��
�ʴ�Ϊ��CuCl+FeCl3=CuCl2+FeCl2
��4�����̳�Mn2+������,����̼����狀Ͱ���������̼���̳���,��Ӧ�����ӷ���ʽΪMn2++2HCO3-=MnCO3��+H2O+CO2����Mn2++NH3+HCO3-=MnCO3��+NH4+��
��5���������̣���Һ2����Ҫ������Ϊ�������������Ϊ笠����ӣ�����Ҫ����Ϊ����泥����Խᾧ��õ�����Ϊ(NH4)2SO4�������д��ڼ��백���ϰ��IJ��������Կ�ѭ��������Ϊ�������ʴ�Ϊ��(NH4)2SO4��������
��6������ͼ�е��ӵ������֪��CuΪ����������H2Sת��H+��Cuת��Cu2S�����Ըõ缫�ķ�ӦΪ��Cu+H2S-2e-=Cu2S��+2H+ ��

 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д�