题目内容
【题目】2019年12月4日“全球碳计划”发布报告说,全球CO2排放量增速趋缓。人们还需要更有力的政策来逐步淘汰化石燃料的使用。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是用CO2转化为成为有机物实现碳循环。如:
C2H4(g)+H2O(l) ![]() C2H5OH(l) ΔH=-44.2kJ·mol-1
C2H5OH(l) ΔH=-44.2kJ·mol-1
2CO2(g)+2H2O(l) ![]() C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1
C2H4(g)+3O2(g) ΔH=+1411.0kJ·mol-1
已知2CO2(g)+3H2O(l) ![]() C2H5OH(l)+3O2(g)其正反应的活化能为EakJ·mol-1,则逆反应的活化能为___kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,反应的离子方程式为___,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为___。
C2H5OH(l)+3O2(g)其正反应的活化能为EakJ·mol-1,则逆反应的活化能为___kJ·mol-1。乙烯与HCl加成生成的氯乙烷在碱性条件下水解也得到乙醇,反应的离子方程式为___,v=kcm(CH3CH2Cl)cn(OH-)为速率方程,研究表明,CH3CH2Cl浓度减半,反应速率减半,而OH-浓度减半对反应速率没有影响,则反应速率方程式为___。
(2)利用工业废气中的CO2可以制取甲醇和水蒸气,一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如图所示:
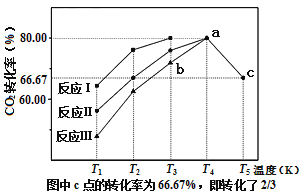
①催化剂效果最佳的反应是___(填“反应I”,“反应II”,“反应III”)。
②b点v(正)___v(逆)(填“>”,“<”,“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是___。
④c点时该反应的平衡常数K=___。
(3)中国科学家首次用CO2高效合成乙酸,其反应路径如图所示:
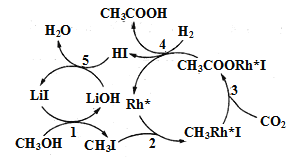
①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式___。
②根据图示,写出总反应的化学方程式:___。
【答案】Ea-1366.8 CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq) v=kc(CH3CH2Cl) 反应I > 该反应为放热反应,温度升高,平衡逆向移动 ![]() CO2+6e-+6H+=CH3OH+H2O CH3OH+CO2+H2
CO2+6e-+6H+=CH3OH+H2O CH3OH+CO2+H2![]() CH3COOH+H2O
CH3COOH+H2O
【解析】
(1)应用盖斯定律,计算出2CO2(g)+3H2O(l)![]() C2H5OH(l)+3O2(g)的ΔH,并按照ΔH=正反应的活化能-逆反应的活化能,计算逆反应的活化能,氯乙烷在碱性条件下水解得到乙醇和氯化钠,据此写反应的离子方程式,按反应物浓度对速率的影响数据,写反应速率方程式即可;
C2H5OH(l)+3O2(g)的ΔH,并按照ΔH=正反应的活化能-逆反应的活化能,计算逆反应的活化能,氯乙烷在碱性条件下水解得到乙醇和氯化钠,据此写反应的离子方程式,按反应物浓度对速率的影响数据,写反应速率方程式即可;
(2)一定条件下,往2L恒容密闭容器中充入1molCO2和3molH2后反应得到甲醇和水蒸气,反应方程式为![]() ,按照CO2的转化率随温度变化关系图分析、计算回答即可;
,按照CO2的转化率随温度变化关系图分析、计算回答即可;
(3)①原料中的CH3OH可通过电解法由CO2制取,二氧化碳在阴极反应,故是二氧化碳得电子被还原的反应,据此写生成CH3OH的电极反应式;
②根据图示,找出总的反应物、催化剂和产物,据此写总反应的化学方程式;
(1)反应①C2H4(g)+H2O(l)![]() C2H5OH(l) ΔH1=-44.2kJ·mol-1
C2H5OH(l) ΔH1=-44.2kJ·mol-1
反应②2CO2(g)+2H2O(l)![]() C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
应用盖斯定律,反应①+反应②得到:2CO2(g)+3H2O(l)![]() C2H5OH(l)+3O2(g),则该反应的ΔH=ΔH1+ΔH2,故ΔH =-44.2kJ·mol-1+(+1411.0kJ·mol-1)=+1366.8kJ·mol-1,因为ΔH=正反应的活化能-逆反应的活化能,正反应的活化能为EakJ·mol-1,则逆反应的活化能为Ea-1366.8kJ·mol-1;
C2H5OH(l)+3O2(g),则该反应的ΔH=ΔH1+ΔH2,故ΔH =-44.2kJ·mol-1+(+1411.0kJ·mol-1)=+1366.8kJ·mol-1,因为ΔH=正反应的活化能-逆反应的活化能,正反应的活化能为EakJ·mol-1,则逆反应的活化能为Ea-1366.8kJ·mol-1;
答案为:Ea-1366.8;
氯乙烷在碱性条件下水解得到乙醇和氯化钠,则反应的离子方程式为CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq);该反应的速率方程为v=kcm(CH3CH2Cl)cn(OH-),研究表明,CH3CH2Cl浓度减半,反应速率减半,则可知m=1,而OH-浓度减半对反应速率没有影响,则n=0,故反应速率方程式为v=kc(CH3CH2Cl);
答案为:CH3CH2Cl(aq)+OH-(aq)→C2H5OH(aq)+Cl-(aq);v=kc(CH3CH2Cl);
(2)一定条件下,密闭容器中发生的反应为![]() ,①相同温度下相同时间内CO2转化率最高的是反应Ⅰ的图线,故最佳催化剂为反应I;
,①相同温度下相同时间内CO2转化率最高的是反应Ⅰ的图线,故最佳催化剂为反应I;
答案为:反应I;
②图线中b点未达到平衡状态,则v(正) >v(逆);
答案为:>;
③若此反应在a点时已达平衡状态,则继续升温就会使平衡移动,故a点的转化率比c点高的原因为该反应为放热反应,温度升高,平衡逆向移动;
答案为:该反应为放热反应,温度升高,平衡逆向移动;
④该条件下,一开始往2L恒容密闭容器中充入1molCO2和3molH2,由图知,c点时二氧化碳转化了![]() ,则
,则 ,平衡时2L容器内
,平衡时2L容器内![]() 的浓度依次为
的浓度依次为![]() ,则该反应的平衡常数
,则该反应的平衡常数![]() =
= =
=![]() ;
;
答案为: ![]() ;
;
(3)①通过电解法由CO2制取CH3OH,碳元素化合价降低,故是二氧化碳得电子被还原的反应,故二氧化碳在阴极反应,则生成CH3OH的电极反应式为CO2+6e-+6H+=CH3OH+H2O;
②根据图示,CH3OH、CO2和H2在LiI、Rh+催化作用下生产CH3COOH和H2O,总反应的化学方程式为CH3OH+CO2+H2![]() CH3COOH+H2O;
CH3COOH+H2O;
答案为:CO2+6e-+6H+=CH3OH+H2O;CH3OH+CO2+H2![]() CH3COOH+H2O。
CH3COOH+H2O。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案