题目内容
【题目】PT(KHC2O4·H2C2O4·2H2O,名称:四草酸钾)是一种分析试剂。室温时,H2C2O4的pKa1、pKa2分别为1.23、4.19(pKa=-lgKa)。下列说法不正确的是( )
A.0.1mol·L-1PT溶液中:c(HC2O![]() )>c(K+)>c(H2C2O4)
)>c(K+)>c(H2C2O4)
B.0.1mol·L-1PT中滴加NaOH至溶液pH=4.19:c(C2O![]() )=c(HC2O
)=c(HC2O![]() )
)
C.0.1mol·L-1PT中滴加NaOH至溶液呈中性:c(K+)>c(Na+)>c(HC2O![]() )>c(C2O
)>c(C2O![]() )
)
D.0.1mol·L-1PT与0.1mol·L-1KOH溶液等体积混合,溶液中水的电离程度比纯水的大
【答案】CD
【解析】
A.H2C2O4的第一步电离程度大于第二步电离程度,钾离子不电离也不水解,且![]() ,则
,则![]() 水解平衡常数Kh=
水解平衡常数Kh=![]() <Ka1,说明
<Ka1,说明![]() 的电离程度大于
的电离程度大于![]() 水解程度,所以c(
水解程度,所以c(![]() )>c(K+)>c(H2C2O4),故A正确;
)>c(K+)>c(H2C2O4),故A正确;
B.Ka2=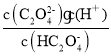 =104.19,0.1molL1PT中滴加NaOH至溶液pH=4.19,则c(
=104.19,0.1molL1PT中滴加NaOH至溶液pH=4.19,则c(![]() )=
)=![]() ,故B正确;
,故B正确;
C.![]() 水解平衡常数Kh=
水解平衡常数Kh=![]() <Ka2,说明
<Ka2,说明![]() 的电离程度大于水解程度导致溶液呈酸性,要使混合溶液呈中性,则加入的n(NaOH)大于n(KHC2O4H2C2O42H2O),则c(K+)<c(Na+),故C错误;
的电离程度大于水解程度导致溶液呈酸性,要使混合溶液呈中性,则加入的n(NaOH)大于n(KHC2O4H2C2O42H2O),则c(K+)<c(Na+),故C错误;
D.0.1molL1PT与0.1molL1KOH溶液等体积混合,二者恰好完全反应生成KHC2O4,因![]() 的电离程度大于水解程度导致溶液呈酸性,其对水的电离的抑制作用大于促进作用,所以其溶液中水的电离程度小于纯水,故D错误;
的电离程度大于水解程度导致溶液呈酸性,其对水的电离的抑制作用大于促进作用,所以其溶液中水的电离程度小于纯水,故D错误;
故选:CD。

【题目】生产工艺的实现,涉及能源消耗、环境保护、综合经济效益等等。
Ⅰ.(1)下列单元操作中采用了热交换工艺设备,以利用化学反应中放出的热量,达到节能减排效果的有_______(填序号)。
A. 电解食盐水制烧碱 B. 合成氨中的催化合成
C. 硫酸生产中的催化氧化 D. 煅烧石灰石制取生石灰
Ⅱ.以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.20~2.90 | 2.8~3.32 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
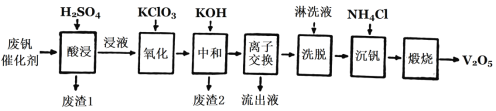
回答下列问题:
(2)“酸浸”时V2O4转化为VO2+,反应的离子方程式为_________,同时V2O5转化为VO2+。“废渣1”的主要成分是________。
(3)“氧化”中使VO2+变为VO2+,则“氧化”环节中氧化剂与还原剂的物质的量之比为_____。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124-![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高化洗脱效率,淋洗液应该呈_______性(填“酸”“碱”“中”)。
(5)检验“流出液”中含量最多的阳离子,其实验操作步骤是____。
(6)“煅烧”中发生反应的化学方程式2NH4VO3![]() V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
V2O5+H2O+2NH3↑,写出“沉钒”过程的离子方程式__________。
(7)若有100 kg该废钒催化剂,若转化中钒元素利用率为80%,则最多可回收到V2O5__kg(保留小数点后一位)。