题目内容
5.G、Q、X、Y、Z五种物质均为氯的含氧化合物,现在不了解它们的化学式,但知道它们在一定条件下具有如下转化关系(未配平)(1)G→Q+NaCl
(2)Q+H20$\stackrel{电解}{→}$X+H2
(3)Y+NaOH→G+Q+H2O
(4)Z+NaOH→X+Q+H2O
这五种化合物中氯的化合价由低到高的顺序是( )
| A. | Q G Z Y X | B. | Z X G Y Q | C. | G Y Z Q X | D. | G Y Q Z X |
分析 G、Q、X、Y、Z均为氯的含氧化合物,物质发生歧化反应时,元素的化合价即升高又降低,结合氧化还原反应中Cl元素的化合价升降来分析解答.
解答 解:(1)G→Q十NaCl中,G中Cl元素的化合价即升高又降低,NaCl中Cl元素为-1价是最低价,则Q中Cl元素的化合价高于G中Cl元素的化合价,即Q>G>-1,
(2)Q+H20$\stackrel{电解}{→}$X+H2,电解是H元素的化合价降低,则Q中Cl元素的化合价升高,所以Cl元素的化合价为X>Q,
(3)Y十NaOH→G十Q十H2O中,Y中Cl元素的化合价即升高又降低,结合(1)可知Cl元素的化合价为Q>Y>G,
(4)Z十NaOH→Q十X十H2O中,Z中Cl元素的化合价即升高又降低,结合(2)可知,Cl元素的化合价为X>Z>Q,
所以五种化合物中氯的化合价由低到高的顺序为GYQZX,
故选D.
点评 本题考查氧化还原反应,明确氧化还原反应中元素的化合价变化是解答本题的关键,难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
3.实验室保存下列试剂,其保存方法和理由描述都正确的是( )
| A. | 固体NaOH,存放在带有橡皮塞的广口瓶中,防止与空气接触被氧化 | |
| B. | 碳酸钠晶体,存放在干燥密封的广口瓶中,防止风化而碎裂成粉末 | |
| C. | 金属钠,存放在有水的广口瓶中,防止氧化 | |
| D. | 过氧化钠粉末,存放在带玻璃塞的细口瓶中,防止吸收水分而变质 |
16.下列实验能够实现的是( )
| A. | 实验室制取乙烯时用酸性高锰酸钾溶液检验产物 | |
| B. | 除乙酸乙酯中少量的乙酸用足量氢氧化钠溶液充分反应后分液即可 | |
| C. | 检验淀粉水解是否完全将水解液中加碱至碱性后加入碘水 | |
| D. | 苯、硝基苯、乙醇、乙酸四种物质只用碳酸氢钠溶液一种试剂就能鉴别 |
13.下列各组互为同系物的是( )
| A. | CH3( CH2)2 CH3 和 CH3 CH=CH CH3 | |
| B. | CH3( CH2)2 CH3 和 CH3 CH2 CH( CH3) CH2 CH3 | |
| C. | CH3 C≡C CH3 和CH2=CH CH=CH2 | |
| D. | CH3 C≡C CH3 和 CH3 CH=CH CH3 |
20.将0.5mol SO2(g)和0.3mol O2(g)放入容积为10L的密闭容器中,反应2SO2(g)+O2(g)?2SO3(g)在一定条件下达到平衡时测得n(SO3)=0.4mol,则该条件下反应的平衡常数K为( )
| A. | 160 | B. | 160mol-1 | C. | 1600mol•L-1 | D. | 1600L•mol-1 |
14.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,2.24 L CCl4所含的原子数为0.5 NA | |
| B. | 标准状况下0.5mol NO和0.5mol O2组成的混合气体的体积约为22.4L | |
| C. | 78 g Na2O2 与足量水反应转移电子数为NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA |
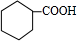 .
.