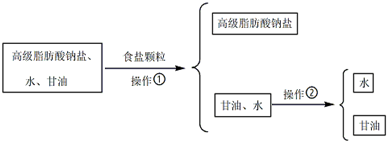
题目内容
10.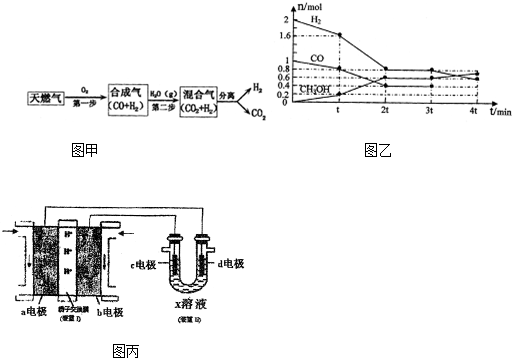
(1)CCS技术是将工业和有关能源产业中所生产的CO2进行捕捉与封存的技术,被认为是拯救地球、应对全球气候变化最重要的手段之一.其中一种以天燃气为燃料的“燃烧前捕获系统”的简单流程图如图甲所示(部分条件及物质未标出).回答下列问题:
CH4在催化剂作用下实现第一步,也叫CH4不完全燃烧,1gCH4不完全燃烧反应放出2.21kJ热量,写出该反应的热化学方程式2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ•mol-1.
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用(1)转化中得到的合成气制备甲醇.反应为CO(g)+2H2(g)?CH3OH(g)某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见如图乙:
①根据上图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率v(H2)=$\frac{1}{5t}$mol/(L•min)
②t min至2tmin时速率变化的原因可能是反应受热或使用了催化剂;
③3tmin时对反应体系采取了一个措施,至4tmin时CO的物质的量为0.5mol,请完成图乙CO的曲线.
(3)某同学按图丙所示的装置用甲醇燃料电池(装置Ⅰ)进行电解的相关操作,以测定铜的相对原子质量,其中c电极为铜棒,d电极为石墨,X溶液为500mL0.4mol/L硫酸铜溶液.当装置Ⅱ中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg(m<12.8).
①装置Ⅰ中、H+向a极(填“a”或“b”)移动;b电极上发生的反应为CH3OH-6eˉ+H2O=CO2+6H+.
②铜的相对原子质量的表达式为$\frac{11200m}{{V}_{{\;}_{1}}}$(用m和V1的代数式表示).
分析 (1)根据流程图可知甲烷不完全燃烧生成一氧化碳和氢气,依据热化学方程式的书写方法写出,标注物质聚集状态和对应焓变;
(2)①根据v=$\frac{△c}{△t}$进行计算;
②反应速率加快,而且在t的时刻,达平衡状态进行分析求解;
③平衡正向移动,是增加CO的量导致平衡正向移动;
(3)①由装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg可知,d极为阳极,而c极为阴极;
②根据阳极产生气体的体积,求出整个过程中转移电子的物质的量,然后铜的相对原子质量.
解答 解:(1)根据流程图可知甲烷不完全燃烧生成一氧化碳和氢气,1gCH4燃烧生成一氧化碳和氢气放热2.21kJ,16g甲烷燃烧生成二氧化碳和液态水放出热量16×2.21kJ=35.36KJ,16g甲烷为1mol,则甲烷不完全燃烧的热化学方程式为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ•mol-1,
故答案为:2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=-70.72 kJ•mol-1;
(2)①根据v=$\frac{△c}{△t}$=$\frac{\frac{2-1.6}{2}}{t}$=$\frac{1}{5t}$mol/(L•min),故答案为:$\frac{1}{5t}$mol/(L•min);
②反应速率加快,而且在t的时刻,达平衡状态,可能是反应受热或使用了催化剂,故答案为:反应受热或使用了催化剂;
③平衡正向移动,是增加CO的量导致平衡正向移动,所以图象为: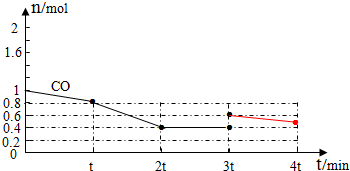 ,故答案为:
,故答案为: ;
;
(3)①由装置II中某电极上收集到标准状况下的气体V1mL时,另一电极增重mg可知,d极为阳极,而c极为阴极,所以与d极相连的a极为正极,原电池中阳离子向正极移动,b电极为负极是燃料发生氧化反应,反应方程式为:CH3OH-6eˉ+H2O=CO2+6H+,故答案为:a、CH3OH-6eˉ+H2O=CO2+6H+;
②整个过程中转移电子的物质的量为:$\frac{1{0}^{-3}×V1}{22.4}$,所以生成铜的物质的量为:$\frac{{V}_{1}}{11200}$,所以铜的相对原子质量的表达式为$\frac{11200m}{{V}_{{\;}_{1}}}$,故答案为:$\frac{11200m}{{V}_{{\;}_{1}}}$.
点评 本题考查化学反应热、平衡的移动和电化学的相关知识,综合性强,比较有难度.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 原子半径大小顺序:C>D>B>A | |
| B. | 由B和C元素组成的化合物,可以既含有离子键,又含共价键 | |
| C. | 元素B、D、E分别与A形成的化合物中,熔沸点最高的是B与A形成的化合物 | |
| D. | 元素D与C形成的化合物在空气中长期放置不易变质 |
| A. | n-3 | B. | n-1 | C. | n+5 | D. | n+2 |
(1)G→Q+NaCl
(2)Q+H20$\stackrel{电解}{→}$X+H2
(3)Y+NaOH→G+Q+H2O
(4)Z+NaOH→X+Q+H2O
这五种化合物中氯的化合价由低到高的顺序是( )
| A. | Q G Z Y X | B. | Z X G Y Q | C. | G Y Z Q X | D. | G Y Q Z X |
| A. | H2→H2O | B. | H+→H2 | C. | HClO→HCl | D. | ClO3-→Cl- |
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10 -10m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | -- |
| 最低负价 | -- | -1 | -- | --- | -3 | -2 | |
| A. | X、Z、M的最简单离子半径大小为X>M>Z | |
| B. | X、Z、R的最高价氧化物的水化物之间不可两两相互反应 | |
| C. | R的氢化物比Q的氢化物沸点高、更稳定 | |
| D. | Y的氢化物的水溶液可用于雕刻玻璃 |
 +3NaOH→3C17H35COONa+
+3NaOH→3C17H35COONa+