题目内容
14.设NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 标准状况下,2.24 L CCl4所含的原子数为0.5 NA | |
| B. | 标准状况下0.5mol NO和0.5mol O2组成的混合气体的体积约为22.4L | |
| C. | 78 g Na2O2 与足量水反应转移电子数为NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA |
分析 A、标况下,四氯化碳为液态;
B、NO与氧气反应后生成NO2,而NO2中存在平衡:2NO2?N2O4;
C、过氧化钠与水的反应为歧化反应;
D、溶液体积不明确.
解答 解:A、标况下,四氯化碳为液态不能根据气体摩尔体积来计算其物质的量,故A错误;
B、0.5mol NO和0.5mol O2反应时,氧气过量0.25mol,反应后生成0.5molNO2,而NO2中存在平衡:2NO2?N2O4,导致气体气体减小,故所得的混合气体的体积小于16.8L,故B错误;
C、78g过氧化钠的物质的量为1mol,而过氧化钠与水的反应为歧化反应,1mol过氧化钠转移1mol电子,即NA个,故C正确;
D、溶液体积不明确,故溶液中的氯离子的个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.室温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | c(H+)=0.1mol/L的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ | |
| C. | 在由水电离出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- | |
| D. | c(Fe2+)=0.1mol/L的溶液:H+、Al3+、NO3-、SCN- |
5.G、Q、X、Y、Z五种物质均为氯的含氧化合物,现在不了解它们的化学式,但知道它们在一定条件下具有如下转化关系(未配平)
(1)G→Q+NaCl
(2)Q+H20$\stackrel{电解}{→}$X+H2
(3)Y+NaOH→G+Q+H2O
(4)Z+NaOH→X+Q+H2O
这五种化合物中氯的化合价由低到高的顺序是( )
(1)G→Q+NaCl
(2)Q+H20$\stackrel{电解}{→}$X+H2
(3)Y+NaOH→G+Q+H2O
(4)Z+NaOH→X+Q+H2O
这五种化合物中氯的化合价由低到高的顺序是( )
| A. | Q G Z Y X | B. | Z X G Y Q | C. | G Y Z Q X | D. | G Y Q Z X |
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | 次氯酸钠溶液中加入双氧水有氧气放出:ClO-+H2O2═O2↑+Cl-+H2O | |
| B. | 碳酸钙溶于稀醋酸溶液:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 用稀硝酸洗涤做过银镜反应的试管:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| D. | 苯酚钠溶液中通入少量CO2: |
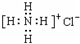
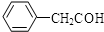
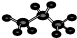
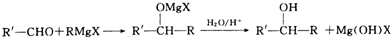
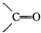 )化合物:
)化合物: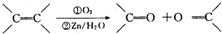
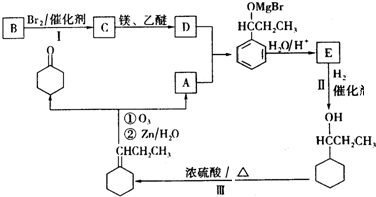
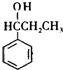 .
.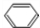 +Br2$\stackrel{催化剂}{→}$
+Br2$\stackrel{催化剂}{→}$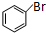 +HBr.
+HBr.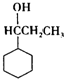 .
.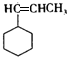 .F在一定条件下发生加聚反应的化学方程式是n
.F在一定条件下发生加聚反应的化学方程式是n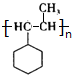 .
.