题目内容
相同温度下,根据三种酸的电离平衡常数,下列判断正确的是( )
A.三种酸的强弱关系: HX>HY>HZ
B.反应 HZ+Y-===HY+Z-能够发生
C.相同温度下,0.1 mol?L?1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol?L?1HX溶液的电离常数大于0.1 mol?L?1HX
| 酸 | HX | HY | HZ |
| Ka/mol·L-1 | 9×10-7 | 9×10-6 | 2×10-2 |
B.反应 HZ+Y-===HY+Z-能够发生
C.相同温度下,0.1 mol?L?1的NaX、NaY、NaZ溶液,NaZ溶液pH最大
D.相同温度下,1 mol?L?1HX溶液的电离常数大于0.1 mol?L?1HX
B
试题分析:电离常数越大,酸性越强,据此可知.三种酸的强弱关系是HX<HY<HZ,A不正确;根据较强的酸制备减弱的酸的原理可知,选项B正确;酸性越弱,相应的钠盐越容易水解,碱性越强,C不正确,NaX溶液pH最大;弱酸的电离常数只与温度有关系,D不正确,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计贴近高考,基础性强,侧重对学生能力的培养。该题的关键是明确电离常数的含义以及影响因素,然后具体问题、具体分析即可。

练习册系列答案
相关题目
 2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。 2NH3,下列有关说法正确的是( )
2NH3,下列有关说法正确的是( ) 2C(气)△H < 0,这个可逆反应的正确图像为( )
2C(气)△H < 0,这个可逆反应的正确图像为( )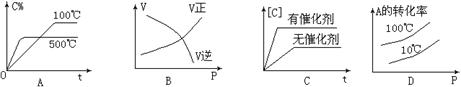
 2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程)
2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程) CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程)
CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程) 4NO2(g)+ O2(g)。反应5min后,测得N2O5的物质的量为2mol,求:(要求写详细解题过程)
4NO2(g)+ O2(g)。反应5min后,测得N2O5的物质的量为2mol,求:(要求写详细解题过程) 2Z(g),此反应达到平衡的标志是
2Z(g),此反应达到平衡的标志是  2C(g)达到平衡标志的是( )
2C(g)达到平衡标志的是( )