题目内容
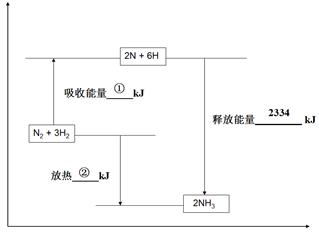
(1)在一定温度下,向一个容积不变的容器中,通入2molN2和8molH2及固体催化剂,使之反应。已知:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程)
2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程)
①平衡时N2的物质的量 , H2的转化率
②达到平衡时,放出的热量为 。
(2)在一个容积为500 mL的密闭容器中,充入5 mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应:2H2(g)+CO(g) CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程)
CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程)
①以H2的浓度变化表示的该反应的速率
②达平衡时CO的转化率
③该温度下的K
 2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程)
2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程)①平衡时N2的物质的量 , H2的转化率
②达到平衡时,放出的热量为 。
(2)在一个容积为500 mL的密闭容器中,充入5 mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应:2H2(g)+CO(g)
 CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程)
CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程)①以H2的浓度变化表示的该反应的速率
②达平衡时CO的转化率
③该温度下的K
(1)①1摩尔
②37.5%
③92.2kJ
(2)①v(H2)=0.8 mol/(L·min)
②50%
③0.028
②37.5%
③92.2kJ
(2)①v(H2)=0.8 mol/(L·min)
②50%
③0.028
试题分析:解:(1)设反应掉的氮气的物质的量为x,即
N2(g) +3H2(g)
 2NH3(g)
2NH3(g)起始的物质的量(mol) 2 8 0
转化的物质的量(mol) x 3x 2x
平衡的物质的量(mol)2-x 8-3x 2x
根据PV=nRT,所以(10-2x)/10=80%,所以x为1mol,
所以平衡时N2的物质的量为2-1=1mol,
H2的转化率=3x/8=3*1/8*100%=37.5%
达到平衡时,放出的热量=1*92.2kJ=92.2kJ
(2)设反应掉的氢气的物质的量为x,即
2H2(g) + CO(g)
 CH3OH(g)
CH3OH(g)起始的物质的量(mol) 5 2 0
转化的物质的量(mol) x 0.5x 0.5x
平衡的物质的量(mol) 5-x 2-0.5x 0.5x
有因为CH3OH蒸气的浓度为2 mol/L,所以0.5x=2×0.5,所以x=2mol,
所以以H2的浓度变化表示的反应速率v(H2)="2/0.5/5=0.8" mol/(L·min),
达平衡时CO的转化率=1/2×100%=50%,
K=c(CH3OH)/c2(H2)c(CO)=2/(6*6*2)=0.028。
点评:本题综合考查了化学反应,平衡常数的相关计算,有一定的综合性,考查的知识点比较全面,是一道不错的计算题

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 CH3OH(g)
CH3OH(g)
 CO2(g)+H2(g);△H<0 试回答下列问题:
CO2(g)+H2(g);△H<0 试回答下列问题: 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
 nW(g);ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图: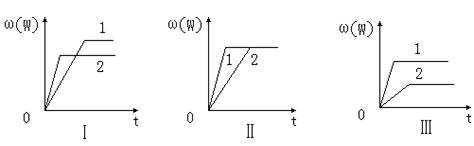
 2NH3(g)+
2NH3(g)+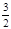 O2(g) △H="+765.0kJ" /mol。
O2(g) △H="+765.0kJ" /mol。
 CO(g)+H2(g)在一可变容积的密闭容器中进行,达到平衡,下列条件能使平衡移动的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,达到平衡,下列条件能使平衡移动的是( )