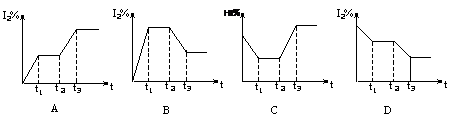题目内容
在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g) 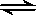 4NO2(g)+ O2(g)。反应5min后,测得N2O5的物质的量为2mol,求:(要求写详细解题过程)
4NO2(g)+ O2(g)。反应5min后,测得N2O5的物质的量为2mol,求:(要求写详细解题过程)
(1)5min末NO2的浓度?
(2)用氧气的浓度变化来表示5min内的该反应的平均速率?
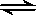 4NO2(g)+ O2(g)。反应5min后,测得N2O5的物质的量为2mol,求:(要求写详细解题过程)
4NO2(g)+ O2(g)。反应5min后,测得N2O5的物质的量为2mol,求:(要求写详细解题过程)(1)5min末NO2的浓度?
(2)用氧气的浓度变化来表示5min内的该反应的平均速率?
(每小题3分)
(1) 2mol·L-1(2) 0.1 mol·(L·min)-1
(1) 2mol·L-1(2) 0.1 mol·(L·min)-1
试题分析:根据三段式解题法,求出反应混合物各组分物质的量的变化量、5min时各组分的物质的量,
2N2O5(g)
 4NO2(g)+O2(g)
4NO2(g)+O2(g)开始(mol): 4 0 0
变化(mol): 2 4 1
5min时(mol): 2 4 1
(1)5min末NO2的浓度为4mol÷2L= 2mol·L-1。
(2)用氧气的浓度变化来表示5min内的该反应的平均速率为1mol÷2L÷5min=0.1 mol·(L·min)-1。
点评:考查反应速率、化学平衡的有关计算,难度不大,注意三段式解题法运用与基础知识积累。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
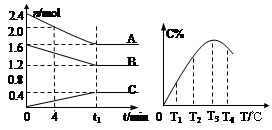
 H2(g)+I2(g)已达到平衡的是( )
H2(g)+I2(g)已达到平衡的是( ) Fe(s)+ CO2(g) △H>0
Fe(s)+ CO2(g) △H>0 nW(g);ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:
nW(g);ΔH,某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图: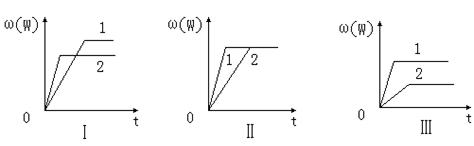
 Z (g)+R (g) ⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
Z (g)+R (g) ⊿H<0 的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
 2C(g)。若经2s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是( )
2C(g)。若经2s后测得C的浓度为0.6 mol/L,现有下列几种说法,其中正确的是( ) H2(g)+I2(g) △H<0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
H2(g)+I2(g) △H<0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是