题目内容
恒温条件下,将2.0molSO2与amolO2混合通入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
求:⑴a的值。
⑵平衡时SO2的转化率。
 2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。求:⑴a的值。
⑵平衡时SO2的转化率。
(1)3.65mol (2)65%
试题分析:(1) 2SO2(g)+O2(g)
 2SO3(g)
2SO3(g)起始量(mol) 2.0 a 0
变化量(mol) 1.3 0.65 1.3
平衡量(mol) 0.7 3.0 1.3
则a=3.0mol+0.65mol=3.65mol
(2)平衡时SO3的转化率=

点评:在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
 2SO3的说法中,不正确的是
2SO3的说法中,不正确的是  3B(?)+C(?)(正反应吸热)达到化学平衡后,
3B(?)+C(?)(正反应吸热)达到化学平衡后, 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。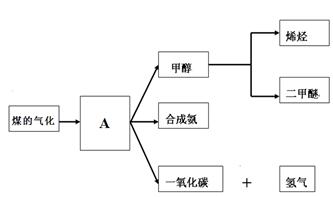
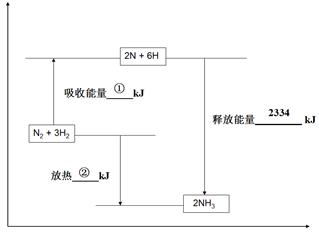
 CH3OH(g)
CH3OH(g)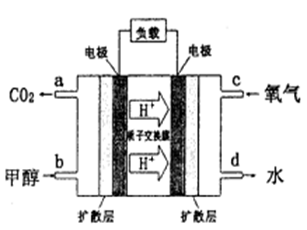
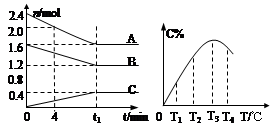
 xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
xC(g)2min时反应达到平衡状态(温度不变),剩余了0.8molB,并测得C的浓度为0.4mol/L,请填写下列空白: