题目内容
16.按要求完成下列各小题:(1)我国古代四大发明之一的黑火药,爆炸时的反应为S+2KNO3+3C=K2S+N2↑+3CO2,该反应中还原剂是C,氧化剂是S和KNO3.
(2)制普通玻璃的原料是纯碱、石灰石、石英,其中石灰石是制水泥和普通玻璃的共同原料.
(3)用氧化物的形式表示某硅酸盐的组成:K4Al4FeSi6O18(OH)74K2O•4Al2O3•Fe2O3•12SiO2•7H2O.
(4)漂白粉的成分是CaCl2和Ca(ClO)2,工业制漂白粉的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O漂白粉在空气中保存不当会失效的原因,用化学方程式表示Ca(ClO)2+CO2+H2O=CaCO3+2HClO
(5)将23gNa与28g硅同时投入水中,理论上放出H23g,写出反应中有关的离子方程式2Na+2H2O=2Na++2OH-+H2↑,Si+2OH-+H2O=SiO32-+2H2↑.
分析 (1)该反应中,硫元素化合价由0价变为-2价,N元素化合价由+5价变为0价,碳元素化合价由0价变为+4价,根据元素化合价变化判断氧化剂和还原剂,氧化剂在反应中被还原,还原剂在反应中被氧化,以此解答;
(2)工业用纯碱、石灰石和石英为原料制备玻璃;制备水泥的原料为石灰石和粘土;
(3)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水;
(4)石灰乳与氢氧化钙反应生成漂白粉CaCl2和Ca(ClO)2;漂白粉在空气中与二氧化碳、水反应生成碳酸钙和HClO;
(5)钠与水反应生成氢氧化钠和氢气,氢氧化钠与硅反应生成硅酸钠和氢气,结合方程式计算.
解答 解:(1)反应S+2KNO3+3C═K2S+N2↑+3CO2↑中,S元素化合价由0价降低到-2价,则S为氧化剂,N元素化合价由+5价降低到0价,则KNO3为氧化剂,C元素化合价由0价升高到+4价,则C为还原剂,
故答案为:C;S、KNO3.
(2)工业用纯碱、石灰石和石英为原料制备玻璃,制备水泥的原料为石灰石和粘土,所以石灰石是制水泥和普通玻璃的共同原料;
故答案为:纯碱、石灰石、石英;石灰石;
(3)硅酸盐由盐的书写改写为氧化物的形式即改写的一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物、水,则K4Al4FeSi6O18(OH)7改写为4K2O•4Al2O3•Fe2O3•12SiO2•7H2O;
故答案为:4K2O•4Al2O3•Fe2O3•12SiO2•7H2O;
(4)石灰乳与氢氧化钙反应生成漂白粉CaCl2和Ca(ClO)2,其反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;漂白粉在空气中与二氧化碳、水反应生成碳酸钙和HClO,其反应方程式:Ca(ClO)2+CO2+H2O=CaCO3+2HClO;
故答案为:CaCl2和Ca(ClO)2;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3+2HClO;
(5)钠与水反应生成氢氧化钠和氢气,其反应为2Na+2H2O=2Na++2OH-+H2↑,
氢氧化钠与硅反应生成硅酸钠和氢气,其反应为Si+2OH-+H2O=SiO32-+2H2↑,
n=$\frac{m}{M}$=$\frac{23g}{23g/mol}$=1mol,n=$\frac{m}{M}$=$\frac{28g}{28g/mol}$=1mol,
则钠与水生成的氢气为0.5mol,Si与氢氧化钠反应生成的氢气为0.5mol,则生成的氢气共1.5mol,所以m(H2)=nM=3g;
故答案为:3;2Na+2H2O=2Na++2OH-+H2↑,Si+2OH-+H2O=SiO32-+2H2↑.
点评 本题考查氧化还原反应、硅酸盐工业、有关方程式的计算,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| 所需试剂 | 方法 | |
| 甲烷(乙烯) | 溴水 | 洗气 |
| 苯(酒精) | 水 | 分液 |
| 粗苯甲酸的提纯 | 水 | 重结晶 |
| A. | 燃烧一定伴有发光现象 | B. | 燃烧一定会放出热量 | ||
| C. | 燃烧一定要有氧气参加 | D. | 金属在燃烧时化合价一定升高 |
| A. | 分子式为C6H6O和C7H8O的两种芳香族化合物一定互为同系物 | |
| B. | 植物油不能使溴的四氯化碳溶液褪色 | |
| C. | 苯酚钠溶液中通入少量二氧化碳生成苯酚和碳酸钠 | |
| D. | 麦芽糖水解产物是葡萄糖,蔗糖水解产物是葡萄糖和果糖 |
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 原子半径/10-10 m | 0.74 | 0.77 | 1.52 | 1.02 | 1.10 | 0.71 | 1.86 | 0.75 | 0.99 |
| 最高化合价 | - | +4 | +1 | +6 | +5 | - | +1 | +5 | +7 |
| 最低化合价 | -2 | -4 | - | -2 | -3 | -1 | - | -3 | -1 |
(2)②和⑨形成的化合物是共价化合物(填“离子化合物”或“共价化合物”).
(3)①、②与氢元素能形成一种常见的有机物,这种物质常用于医疗消毒.在空气中,将灼热的铜丝插入该物质,反应的化学方程式为2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O
(4)16g铜金合金与足量的某浓度的⑧的最高价氧化物对应的水化物反应,将产生的气体与1.12L(标准状况)O2混合,通入水中,气体恰好完全被吸收,重新生成⑧的最高价氧化物对应的水化物.该合金中铜的质量分数为40%.
| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 氧化铝熔点很高,可用于制耐火材料 | |
| C. | 新制氢氧化铜悬浊液具有碱性,可用于检验醛基 | |
| D. | 浓硫酸具有脱水性,可用于干燥氯气 |
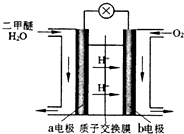 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下: 如图是一个用铂丝作电极,电解Na2SO4溶液的装置,电解液中加有酚酞.闭合开关,电解一段时间后发现:a、b试管中产生气体的体积比为2:1.
如图是一个用铂丝作电极,电解Na2SO4溶液的装置,电解液中加有酚酞.闭合开关,电解一段时间后发现:a、b试管中产生气体的体积比为2:1.