题目内容
7.我们在很多物质的研究中都用到了燃烧反应,你认为不正确的是( )| A. | 燃烧一定伴有发光现象 | B. | 燃烧一定会放出热量 | ||
| C. | 燃烧一定要有氧气参加 | D. | 金属在燃烧时化合价一定升高 |
分析 所有发光放热的剧烈的氧化还原反应称为燃烧,据此分析.
解答 解:发光放热的剧烈的氧化还原反应称为燃烧.
A、燃烧一定发光,故A正确;
B、燃烧一定放热,故B正确;
C、燃烧不一定有氧气参加,氧气只是一种最常见的助燃剂,故C错误;
D、金属元素无负价,故金属单质燃烧时一定被氧化,一定化合价升高,故D正确.
故选C.
点评 本题考查了燃烧的概念,难度不大,应注意的是燃烧不一定有氧气参加.

练习册系列答案
相关题目
18.已知化学反应①:Fe(s)+CO2(g)?FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)?FeO(s)+H2(g),其平衡常数为K2.在温度973K和1173K情况下,K1、K2的值分别如下:
(1)通过表格中的数值可以推断:反应①是吸热(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:
K3=$\frac{[CO][{H}_{2}O]}{[{H}_{2}][C{O}_{2}]}$.
(3)能判断反应③已达平衡状态的是BC.
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式.据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是DF(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(5)若反应③的逆反应速率与时间的关系如图所示:

若反应在t2、t4、t6、t8时各只改变了一种条件(浓度、压强、温度、催化剂),试判断如何改变的条件:t2时升高温度; t4时降低压强.
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)?CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:
K3=$\frac{[CO][{H}_{2}O]}{[{H}_{2}][C{O}_{2}]}$.
(3)能判断反应③已达平衡状态的是BC.
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式.据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是DF(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(5)若反应③的逆反应速率与时间的关系如图所示:

若反应在t2、t4、t6、t8时各只改变了一种条件(浓度、压强、温度、催化剂),试判断如何改变的条件:t2时升高温度; t4时降低压强.
15.下列说法正确的是( )
| A. | O2-的结构示意图为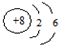 | |
| B. | 某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子 | |
| C. | NH4+与H3O+具有相同的质子数和电子数 | |
| D. | F-、Na+、Mg2+、Al3+是与He原子具有相同电子层结构的离子 |
2.下列说法正确的是( )
| A. | 用玻璃棒蘸取1 mol.L-lCH3 COOH溶液,点在广范pH试纸中部,与标准比色卡对照,测得其pH为3.5 | |
| B. | 用玻璃棒蘸取皂化反应后的混合液,滴入装有热水的试管中,振荡、静置,若有油滴浮在液面上,说明反应液中油脂已完全水解 | |
| C. | 取5 mL SO2水溶液,滴加BaCl2溶液,立即出现白色沉淀,加入盐酸,沉淀消失 | |
| D. | 取5 mL 0.1 mol•L-1KI溶液,加入0.1 mol•L-l FeCl3溶液1 mL,充分反应后继续加入2mLCCl4,振荡、静置后取上层溶液滴加KSCN溶液,溶液变红色 |
12.下列事实中,不能用勒沙特列原理来解释的是( )
| A. | 打开啤酒瓶盖后有大量泡沫溢出 | |
| B. | 实验室用排饱和食盐水的方法收集氯气 | |
| C. | 热的纯碱去油污能力更强 | |
| D. | 夏天将食品储藏在冰箱中 |
17.决定核素种类的是原子结构中的( )
| A. | 质子数 | B. | 最外层电子数 | C. | 质量数 | D. | 质子数和中子数 |