题目内容
5.下表是第二、三周期元素性质的部分数据:| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
| 原子半径/10-10 m | 0.74 | 0.77 | 1.52 | 1.02 | 1.10 | 0.71 | 1.86 | 0.75 | 0.99 |
| 最高化合价 | - | +4 | +1 | +6 | +5 | - | +1 | +5 | +7 |
| 最低化合价 | -2 | -4 | - | -2 | -3 | -1 | - | -3 | -1 |
(2)②和⑨形成的化合物是共价化合物(填“离子化合物”或“共价化合物”).
(3)①、②与氢元素能形成一种常见的有机物,这种物质常用于医疗消毒.在空气中,将灼热的铜丝插入该物质,反应的化学方程式为2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O
(4)16g铜金合金与足量的某浓度的⑧的最高价氧化物对应的水化物反应,将产生的气体与1.12L(标准状况)O2混合,通入水中,气体恰好完全被吸收,重新生成⑧的最高价氧化物对应的水化物.该合金中铜的质量分数为40%.
分析 第二、三周期元素中,①④均有-2价,且④有+6价、原子半径较大,故①为O元素、④为S元素;⑥⑨均有-价,且⑨有+7价、原子半径较大,故⑥为F元素、⑨为Cl元素;⑤⑧均有+5、-3价,处于ⅤA族,⑤的原子半径较大,故⑤为P元素、⑧为N元素;③⑦均有+1价,没有负化合价,原子半径③<⑦,故③为Li、⑦为Na;②有+4、-4价,处于ⅣA族,原子半径小于Cl,故②为C元素,据此解答.
解答 解:第二、三周期元素中,①④均有-2价,且④有+6价、原子半径较大,故①为O元素、④为S元素;⑥⑨均有-价,且⑨有+7价、原子半径较大,故⑥为F元素、⑨为Cl元素;⑤⑧均有+5、-3价,处于ⅤA族,⑤的原子半径较大,故⑤为P元素、⑧为N元素;③⑦均有+1价,没有负化合价,原子半径③<⑦,故③为Li、⑦为Na;②有+4、-4价,处于ⅣA族,原子半径小于Cl,故②为C元素.
(1)同周期自左而右元素金属性减弱、非金属性增强,同主族自上而下元素金属性增强、非金属性减弱,故上述元素中Na的金属性最强,F元素非金属性最强,故答案为:Na;F;
(2)②和⑨形成的化合物是CCl4,属于共价化合物,故答案为:共价化合物;
(3)①、②与氢元素能形成一种常见的有机物,这种物质常用于医疗消毒,则该有机物为C2H5OH,在空气中,将灼热的铜丝插入该物质,反应的化学方程式为:2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2C2H5OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)⑧的最高价氧化物对应的水化物为HNO3,将16g铜金合金与足量的某浓度的HNO3反应生成的气体与1.12L(标准状况)O2混合,通入水中,气体恰好完全被吸收,又生成HNO3,整个过程中Cu失去电子等于氧气获得的电子,氧气物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,根据电子转移守恒,可知Cu的物质的量为$\frac{0.05mol×4}{2}$=0.1mol,故合金中Cu的质量为0.1mol×64g/mol=6.4g,该合金中铜的质量分数为 $\frac{6.4g}{16g}$×100%=40%,
故答案为:40%.
点评 本题考查结构性质位置关系应用,根据化合价、原子半径推断元素是解题关键,侧重对元素周期律的考查,(4)中注意是利用电子转移守恒计算Cu的质量,难度中等.

 应用题作业本系列答案
应用题作业本系列答案| A. | O2-的结构示意图为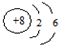 | |
| B. | 某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子 | |
| C. | NH4+与H3O+具有相同的质子数和电子数 | |
| D. | F-、Na+、Mg2+、Al3+是与He原子具有相同电子层结构的离子 |
| 选项 | 实验操作 | 实验目的 |
| A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 检验H2O2的氧化性大于Fe3+ |
| B | 将气体通入稀溴水中 | 检验SO2 中是否混有乙烯 |
| C | 滴入紫色石蕊试液 | 检验酒精中是否混有醋酸 |
| D | 用饱和碳酸钠溶液洗涤后分液 | 除去乙酸乙酯中少量的乙醇和乙酸 |
| A. | A | B. | B | C. | C | D. | D |

| A. | 1 mol该化合物最多可与2 mol H2反应 | |
| B. | 该化合物能与乳酸发生酯化反应 | |
| C. | 该化合物能与氢氧化钠溶液、溴水反应 | |
| D. | 该化合物的同分异构体可能为芳香族化合物 |
| A. | 质子数 | B. | 最外层电子数 | C. | 质量数 | D. | 质子数和中子数 |



