题目内容
11. 二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能源.工业制备二甲醚的生产流程如下:催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ•mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)该反应的△H=-246.1kJ/mol.催化反应室中采用300℃的反应温度,理由是(保证催化剂的活性最大),提高化学反应速率.
(2)已知:反应①在300℃时的化学平衡常数为0.27.该温度下将2mol CO、3molH2和2mol CH3OH充入容积为2L的密闭容器中,此时反应将逆向进行(填“正向进行”、“逆向进行”或“处于平衡状态”).
(3)上述流程中二甲醚精制的实验操作名称为蒸馏.
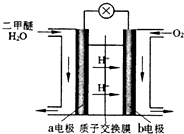
(4)如图为绿色电源“二甲醚燃料电池”的工作原理示意图.该电池工作时,H+向正极移动(填“正”或“负”);a电极的电极反应式为CH3OCH3-12e-+3H2O=2CO2+12H+.
分析 (1)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减;
反应放热,高温不利用原料的利用,温度低原料利用率高,但反应较慢,不利于实际生产;
(2)计算浓度商Qc,Qc=k,处于平衡状态;Qc>k,向逆反应进行;Qc<k,向正反应进行;
(3)分离沸点相差较大的互溶液体,常用方法是蒸馏;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电,由图可知,氢离子移向b电极,a极为负极,二甲醚放电生成二氧化碳与氢离子.
解答 解:(1)已知:①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ/mol,
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol,
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ/mol,
由盖斯定律可知,①×2+②+③得3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol,
反应放热,高温不利用原料的利用,温度低原料利用率高,但反应较慢,不利于实际生产,采用300℃的反应温度,目的(保证催化剂的活性最大),提高化学反应速率,
故答案为:-246.1kJ/mol;(保证催化剂的活性最大),提高化学反应速率;
(2)该温度下将2mol CO、3mol H2和2mol CH3OH充入容积为2L的密闭容器中,此时c(CO)=1mol/L,c(H2)=1.5mol/L,c(CH3OH)=1mol/L,浓度商Qc=$\frac{1}{1×1.{5}^{2}}$=0.44,大于平衡常数0.27,故反应向逆反应进行,
故答案为:逆向进行;
(3)二甲醚、乙醇、水为互溶的液体,沸点不同,采取蒸馏的方法将二甲醚分离,
故答案为:蒸馏;
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,氢离子移向b电极,b电极正极,a极为负极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+,
故答案为:正;CH3OCH3+3H2O-12e-=2CO2+12H+.
点评 本题综合性较大,涉及反应热、化学平衡、原电池、实验基本操作等,难度中等,(4)中电极反应式书写是易错点,可以先写出正极电极反应式,利用总反应式减正极反应式即为负极反应式.

 阅读快车系列答案
阅读快车系列答案| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
| 实验内容 | ① | ② | ③ | ④ |
| 实验现象(填A-D) |
实验①;Mg+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+H2↑
实验②;2Na+2H2O=2NaOH+H2↑
(3)实验结论:第三周期的金属性:Na>Mg>Al.
| A. | 用玻璃棒蘸取1 mol.L-lCH3 COOH溶液,点在广范pH试纸中部,与标准比色卡对照,测得其pH为3.5 | |
| B. | 用玻璃棒蘸取皂化反应后的混合液,滴入装有热水的试管中,振荡、静置,若有油滴浮在液面上,说明反应液中油脂已完全水解 | |
| C. | 取5 mL SO2水溶液,滴加BaCl2溶液,立即出现白色沉淀,加入盐酸,沉淀消失 | |
| D. | 取5 mL 0.1 mol•L-1KI溶液,加入0.1 mol•L-l FeCl3溶液1 mL,充分反应后继续加入2mLCCl4,振荡、静置后取上层溶液滴加KSCN溶液,溶液变红色 |
| A. | 提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 | |
| B. | 重结晶时,溶液冷却速度越慢得到的晶体颗粒越大 | |
| C. | 乙酸与乙醇的混合液可用分液漏斗进行分离 | |
| D. | 用乙醇从碘水中萃取碘 |
| 选项 | 实验操作 | 实验目的 |
| A | 向含有KSCN溶液的FeSO4溶液中滴加硫酸酸化的H2O2溶液 | 检验H2O2的氧化性大于Fe3+ |
| B | 将气体通入稀溴水中 | 检验SO2 中是否混有乙烯 |
| C | 滴入紫色石蕊试液 | 检验酒精中是否混有醋酸 |
| D | 用饱和碳酸钠溶液洗涤后分液 | 除去乙酸乙酯中少量的乙醇和乙酸 |
| A. | A | B. | B | C. | C | D. | D |
