题目内容
4.在相同条件下完全燃烧下列烃甲烷、乙炔、乙烯、丙烷、乙苯按要求选择符合条件的烃的 化学式填空:(1)质量相同时,耗氧量最多的是CH4,生成CO2最多的是C2H2,生成H2O最多的是CH4.
(2)物质的量相同时,耗氧量最多的是C8H10,生成H2O最多的是C8H10.
(3)与同质量丙烯生成CO2的量一定相等的是C2H4,比同质量丙烯生成CO2多的是C8H10、C2H2.
(4)在足量O2中燃烧,恢复到原状况(120℃),混合气体总体积小于原混合气体的是C2H2,混合气体总体积等于原混合气体的是CH4、C2H4.
分析 (1)质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多,生成水的量越多;C元素质量分数越大生成二氧化碳越多;
(2)1mol烃CxHy的耗氧量为(x+$\frac{y}{4}$)mol,分子中H原子数目越多,生成的水越多;
(3)与同质量丙烯生成CO2的量一定相等,则烃中碳元素质量分数相等,比同质量丙烯生成CO2多,则烃中碳元素质量分数大于丙烯;
(4)120℃条件下水为气体,燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),结合反应前后体积变化列方程计算解答.
解答 解:(1)CH4、C2H2、C2H4、C3H8、C8H10中H%大小为:CH4>C3H8>C2H4>C8H10>C2H2,质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多,故完全燃烧时消耗O2的量最多的是CH4;
CH4、C2H2、C2H4、C3H8、C8H10中的C%大小为:CH4<C3H8<C2H4<C8H10<C2H2,质量相同时,分子中C元素的质量分数越大,完全燃烧时生成的CO2越多,故完全燃烧生成的CO2最多的是C2H2;
CH4、C2H2、C2H4、C3H8、C8H10中H%大小为:CH4>C3H8>C2H4>C8H10>C2H2,质量相同时,分子中H元素的质量分数越大,完全燃烧时生成H2O越多,故生成水最多的是CH4,
故答案为:CH4;C2H2;CH4;
(2)1mol烃CxHy的耗氧量为(x+$\frac{y}{4}$)mol,CH4、C2H2、C2H4、C3H8、C8H10中C8H10分子中C原子数目、H原子数目最大,故物质的量相等时C8H10消耗氧气最多,生成的水最多,
故答案为:C8H10;C8H10;
(3)与同质量丙烯生成CO2的量一定相等,则烃中碳元素质量分数相等,烃的最简式相同,即该烃为C2H4,比同质量丙烯生成CO2多,则烃中碳元素质量分数大于丙烯,故C8H10、C2H2符合,
故答案为:C2H4;C8H10、C2H2;
(4)120℃条件下水为气体,燃烧通式CxHy+(x+$\frac{y}{4}$)O2$\frac{\underline{\;点燃\;}}{\;}$xCO2+$\frac{y}{2}$H2O(g),混合气体总体积小于原混合气体,则1+(x+$\frac{y}{4}$)>x+$\frac{y}{2}$,整理可得y<4,故C2H2符合,混合气体总体积等于原混合气体,则则1+(x+$\frac{y}{4}$)=x+$\frac{y}{2}$,解得y=4,故CH4、C2H4符合,
故答案为:C2H2;CH4、C2H4.
点评 本题考查烃燃烧耗氧量、生成二氧化碳与水的量问题,注意利用燃烧通式进行分析解答,注意对规律的理解与掌握.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案| A. | O2-的结构示意图为 | |
| B. | 某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子 | |
| C. | NH4+与H3O+具有相同的质子数和电子数 | |
| D. | F-、Na+、Mg2+、Al3+是与He原子具有相同电子层结构的离子 |
| A. | 打开啤酒瓶盖后有大量泡沫溢出 | |
| B. | 实验室用排饱和食盐水的方法收集氯气 | |
| C. | 热的纯碱去油污能力更强 | |
| D. | 夏天将食品储藏在冰箱中 |
| A. | B、C、D形成的简单离子半径大小顺序Cm+>Dn+>Bx-(m+、n+、x-表示所带电荷) | |
| B. | A、B、E气态氢化物稳定性为E>A>B | |
| C. | C和D的最高价氧化物对应的水化物之间可以发生反应 | |
| D. | E单质是制备太阳能电池的重要材料是因为E的单质导电性强 |
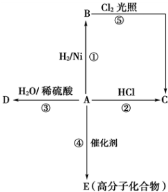 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的 一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的 一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: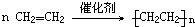 ,反应类型加聚反应.
,反应类型加聚反应.


