题目内容
18.宋代著名法医学家宋慈 的《洗冤集录》中有-银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法不正确的是( )| A. | X的化学式为Ag2S | B. | 银针验毒时,空气中氧气得到电子 | ||
| C. | 反应中Ag和H2S均是还原剂 | D. | 每生成1mo1X,反应转移2mo1 e- |
分析 从质量守恒的角度判断X的化学式,根据元素化合价的变化判断物质在氧化还原反应中的作用,并计算转移的电子的物质的量.
解答 解:A.由质量守恒定律可知X的化学式为Ag2S,故A正确;
B.反应中O元素化合价降低,得电子被还原,故B正确;
C.反应中S元素的化合价没有变化,H2S不是还原剂,故C错误;
D.根据化合价的变化可知每生成1mo1X,反应转移2mo1e-,故D正确.
故选C.
点评 本题考查氧化还原反应,题目难度不大,注意从化合价变化的角度判断,注意该反应中S元素的化合价没有变化,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.2001年11月,美军向躲藏在山洞中的阿富汗恐怖分子使用了一种名为BLU-82的燃料炸弹,这种炸弹爆炸能耗尽山洞中的氧气,使洞中的生物窒息死亡.该炸弹的主装药是环氧乙烷(化学式为C2H4O).关于环氧乙烷的下列说法正确的是( )
| A. | 它是氧化物 | B. | 它含有3种元素 | ||
| C. | 它的摩尔质量是44g | D. | 1 mol环氧乙烷含有2NA个碳原子 |
10.已知甲醛、乙酸和丙酸混合物中,含氧的质量分数为48%,则含碳的质量分数为( )
| A. | 55.43% | B. | 44.57% | C. | 40% | D. | 49% |
7.下列说法正确的是( )
| A. | 在100℃、101 kPa条件下,1 mol液态水汽化时需要吸收40.69 kJ的热量,则H2O(g)═H2O(l)的△H=+40.69 kJ•mol-1 | |
| B. | 已知CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-802.33 kJ•mol-1,则CH4的燃烧热为802.33 kJ | |
| C. | 稀硫酸与0.1 mol•L-1NaOH溶液反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| D. | 已知S(g)+O2(g)═SO2(s)△H1,S(g)+O2(g)═SO2(g)△H2,则△H2<△H1 |
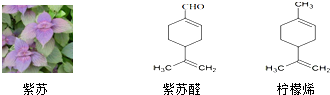
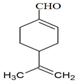 +2Ag[(NH3)2]OH
+2Ag[(NH3)2]OH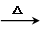
 +2Ag+3NH3+H2O
+2Ag+3NH3+H2O ,通过类似反应柠檬烯可由一种有机物合成得到,该有机物的结构简式为
,通过类似反应柠檬烯可由一种有机物合成得到,该有机物的结构简式为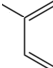 .
.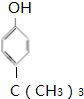 .
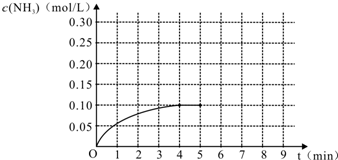
.
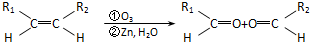
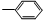 ③-CH═CH2
③-CH═CH2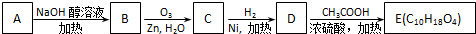
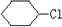 、
、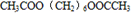 .
.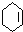
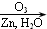
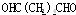 ;
;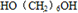 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$